イオン交換クロマトグラフィーの原理
イオン交換クロマトグラフィーは、溶液中のタンパク質と他の分子を電荷の違いに基づいて分離する手法です。
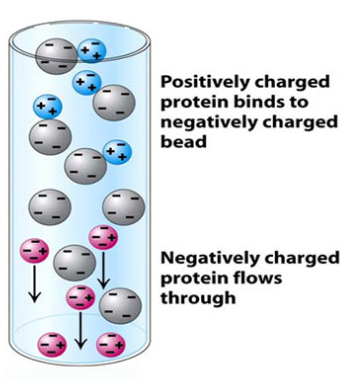
負に帯電した分子は正に帯電した支持体に結合し、正に帯電した分子は負に帯電した支持体に結合します。
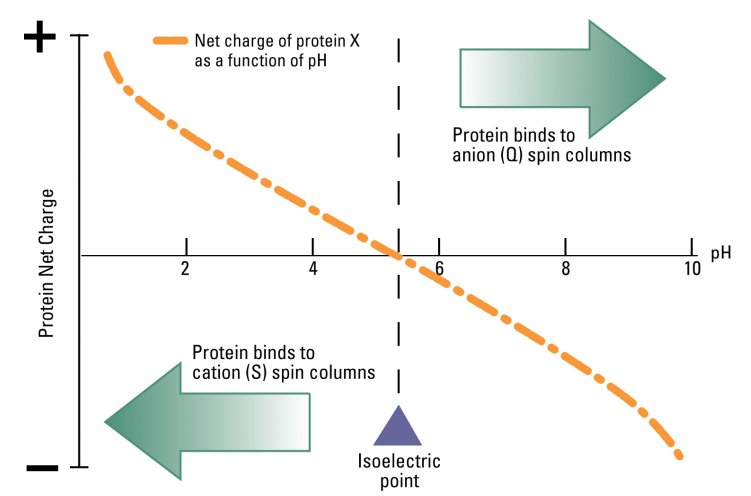
タンパク質の電荷はpHによってコントロールできます。タンパク質をその等電点(pI)より高いpHの緩衝液に溶解したとき、タンパク質は負の電荷を持ちます。一方、タンパク質をその等電点(pI)より低いpHの緩衝液に溶解したとき、タンパク質は正の電荷を持ちます。
出典:Thermo Scientific, TECH TIP#62 Ion exchange chromatography.
<Tips>
SDS-PAGEのランニングバッファーがアルカリ性なのは、タンパク質に負の電荷を持たせ、通電することでタンパク質を陽極側(多くの場合電気泳動槽の下側)へ移動させるためです。
タンパク質と担体を結合させる
等電点pIが5のタンパク質は、pH7の緩衝液に溶解した場合、負の電荷を持ちます。 この場合、タンパク質は、ジエチルアミノエタノール(DEAE)や陰イオン(アニオン)交換カラムのような正に帯電した担体に結合します。
逆に、pIが7のタンパク質はpH5の緩衝液中では正に帯電し、陽イオン(カチオン)交換カラムのような負に帯電した担体に結合します(下図)。
出典:Sagar(2018)Ion exchange chromatography, Online Microbiology Notes.
タンパク質を溶出する
塩化ナトリウムで溶出
陽イオンカラムでも陰イオンカラムでも、担体に結合したタンパク質は塩化ナトリウムで溶出させることができます。
陰イオンカラムを使用する場合、塩化ナトリウムの塩化物Cl-が正の電荷を持つ担体に結合し、結合していた負の電荷を持つタンパク質が担体から離れ、溶出されます。
陽イオンカラムを使用する場合、塩化ナトリウムのナトリウムNa+が負の電荷を持つ担体に結合し、結合していた正の電荷を持つタンパク質が担体から離れ、溶出されます。
pHの変化で溶出
塩化ナトリウムを用いずにタンパク質を溶出する方法もあります。それは、溶出バッファーのpHを変化させることです。タンパク質がカラムの担体と結合しているのは、タンパク質と担体の電荷の状態が正-負の組み合わせだからです。
タンパク質の電荷はpHによって変化させられるので、正-正もしくは負-負の組み合わせにすれば、タンパク質は担体から離れます。
例えば、pH7の陰イオンカラム(担体は正の電荷)に結合したpI 5のタンパク質は、負に荷電して担体に結合している。そこでpHが5以下のバッファー中にタンパク質を置くと、タンパク質は正に荷電し、カラムの担体との結合は失われます。
反対に、pH5で陽イオンカラム(担体は負に荷電)に結合したpI 7のタンパク質(正に荷電)は、pH7以上のバッファーにさらすことで、タンパク質の電荷を負にさせることにより溶出します。










コメントを残す