アガロースゲル電気泳動は、DNA を分子量(塩基対の数)によって分離し、可視化する実験手法です。
負に帯電しているDNAをアガロースゲルの中を通って陽極方向へ移動させます。短いDNAは、アガロースゲルの網目構造にトラップされにくいため、長いDNA断片よりも早くゲル中を移動します。電気泳動が、DNA ラダーとサンプルのDNAのバンドの位置を比較することで、サンプルのDNAの分子量を知ることができます。
本記事では、アガロースゲル電気泳動の方法をなるべくわかりやすくお伝えします。
アガロースゲル電気泳動に必要な装置・ラボウェア
- 電子レンジ耐性フラスコ
- ゲルキャスティングトレイ(Casting tray)
- ウェルコーム(Well combs)
- パワーサプライ(Voltage source)
- ゲルボックス(Gel box)
- 電子レンジ(Microwave)
アガロースゲル電気泳動に必要な試薬類
- アガロース(Agarose, CAS No. 9012-36-6)
- 1×TAEバッファー(TAE buffer)
作り方:こちらの50xTAEバッファーを参照。50xTAEバッファーを精製水で1xに希釈します。
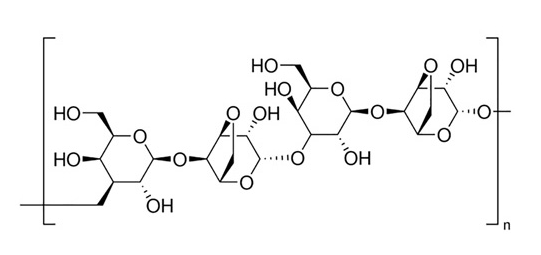
出典:G-Biosciences, Agarose IV
DNAサイズに適したアガロース濃度の目安
アガロース濃度は目的のDNAのサイズで決めます。以下の表を参考にしてください。
アガロース濃度が低いほど大きなDNAに適しています。アガロース濃度が低いとアガロースゲルの網目構造の密度が低いゲルができます。
| アガロース濃度 (g/100mL) |
DNAのサイズ (kb) |
|---|---|
| 0.5 | 1 – 30 |
| 0.7 | 0.8 – 12 |
| 1.0 | 0.5 – 10 |
| 1.2 | 0.4 – 7 |
| 1.5 | 0.2 – 3 |
出典:OpenWetWare, Richard Lab:Agarose Gel Electrophoresis.
ローディングバッファーの色素の分子量
ローディングバッファーは、電気泳動したいDNAサンプルを混合して使用します。Orange G、Bromophenol Blue、Cresol Red、Xylene Cyanol FFなどの色素と、グリセロールなど重みづけ成分が入っています。
色素は電気泳動中に肉眼で見えます。これにより、どの程度の分子量がどの位置にあるかリアルタイムが知ることができます。以下は主要色素の分子量の位置です。
また、重みづけ成分は、DNAをアガロースゲルにアプライした際、DNAサンプルがバッファー浮かないようにするためにあります。
アガロースゲル電気泳動のプロトコル
1%アガロースゲルを使ったプロトコルを紹介します。
アガロースゲルの作り方
アガロースゲルの作製方法です。作り方そのものは難しくありませんが、アガロースを電子レンジで加熱するととても熱くなります。やけどに注意してください。

- 1gのアガロースを測り取り、フラスコへ移します。
- 100mLの1×TAEバッファーをフラスコへ添加します。
- 電子レンジへフラスコを移し、45秒間温めます。
フラスコのフタはしません。 - フラスコを電子レンジから取り出し、フラスコを軽く振り、もう一度電子レンジで45秒間温めます。アガロースが完全に溶けるまでこれを繰り返します。
アガロース溶液が熱くなるのでやけどしないように注意します。 - アガロース溶液を室温に静置し、50℃程度まで冷まします。
およそ5分間置いておくと50℃前後の温度になります。 - アガロース溶液をゲルキャスティングトレイにゆっくり注ぎ、ウェルコームをセットします。
ゲルキャスティングトレイに注いだアガロース溶液に泡が見られる場合、ピペットチップの先端でアガロース溶液から泡を追い出します。 - アガロース溶液が完全に固まるまで、ゲルキャスティングトレイを室温で20-30分間静置します。
アガロースゲルが固まる時間は、冷蔵庫や低温室に置けば15分程度です。あらかじめゲルキャスティングトレイを冷やしておくとさらに早く固まります。
アガロースゲルの作製は完了です。
DNAラダーとサンプルのアプライ
続いて、作製したアガロースゲルにDNAラダーとDNAサンプルを添加します。
- DNAサンプルとローディングバッファー(Loading buffer)を混合します。
備考:6×ローディングバッファーを使用する場合は、液量比で”DNAサンプル:ローディングバッファー”=”5:1″となるよう混合します。 - 固まったアガロースゲルを電気泳動槽のゲルボックスの所定の位置に置きます。
- 1×TAEバッファーをゲルボックスに注ぎます。ゲルが十分に覆われる量を注ぎます。
備考:このバッファーをランニングバッファー(泳動バッファー)と呼びます。 - ピペットを用い、アガロースゲルのウェルのひとつにDNAラダーをゆっくりアプライします。
備考:ピペットでバッファーを吸わないように注意します。DNAラダーがウェルの中に入っていることを確認しながらアプライします。 - 同様に、DNAサンプルを他のウェルにアプライします。
アガロースゲル電気泳動を行う
最後に通電して電気泳動を行います。

出典:OpenWetWare, Richard Lab:Agarose Gel Electrophoresis.
- パワーサプライの設定を、電圧80V-150V、電気泳動時間を60-90分間に設定します。
備考:電気泳動の時間は、アガロースの種類、アガロースゲル濃度、ゲルサイズ、電圧で変わります。泳動先端の色素が85%程度進んだら電気泳動を止めます。 - パワーサプライをオフにし、ゲルボックスからゲルを取り出します。
- DNAを染色してDNAのバンドの位置を確認します。
アガロースゲル電気泳動:操作の動画
アガロースゲルの作製から電気泳動までの操作動画です。
アガロースゲル電気泳動のトラブルシューティング
Q. バンドの形が歪む
DNA のバンドの形を改善させる方法として、
a) 低電圧で長時間ゲルを走らせる
b) 幅の広い/薄いゲルコームを使用する
c) ウェルへの DNA量を減らす
などがあります。
また、5~300bpの低分子 DNAを電気泳動する場合、アガロースゲルではなく、ポリアクリルアミドゲルが適しています。 ポリアクリルアミドゲルは、アガロースゲルよいも架橋構造が密で、小さなDNAでもトラップ可能です。
Q. DNAバンドの分離能(Resolution)が悪い
低分子DNAの分離能を上げる場合、ゲルのアガロース濃度を高くします。逆に、高分子DNAの分離能を上げる場合、ゲルのアガロース濃度を低くします。
Q. パワーサプライの電源をオンにしても通電されない。
電極プラグの陽極と陰極を逆に指している、もしくはランニングバッファーの量が少ない。
こちらの記事もチェック!
DNAおよびRNAのエタノール沈殿【原理とプロトコル】










コメントを残す