X-Galを用いたブルー・ホワイトセレクションの原理とプロトコルを紹介します。ブルー・ホワイトセレクション(Blue/white selection; 青白選択)は、ブルー・ホワイトスクリーン(Blue/white screen)やブルー・ホワイトスクリーニング(Blue/white screening)、カラーセレクション(Color selection)とも呼ばれます。
ブルー・ホワイトセレクション(青白選択)の目的
結論:意図しない形質転換細胞を除く
ブルー・ホワイトセレクションは、「抗生物質によるセレクションで除けないが、目的の形質転換細胞ではない群を除く」ために行います。
ただし、後述しますが、ブルー・ホワイトセレクションで完璧に目的の形質転換細胞だけを選抜することはできません。完璧に目的の形質転換細胞だけに絞り込むには、追加の解析が必要です。
まずはブルー・ホワイトセレクションが何をやっているのかをわかりやすく説明します。
ブルー・ホワイトセレクションは何をしている?
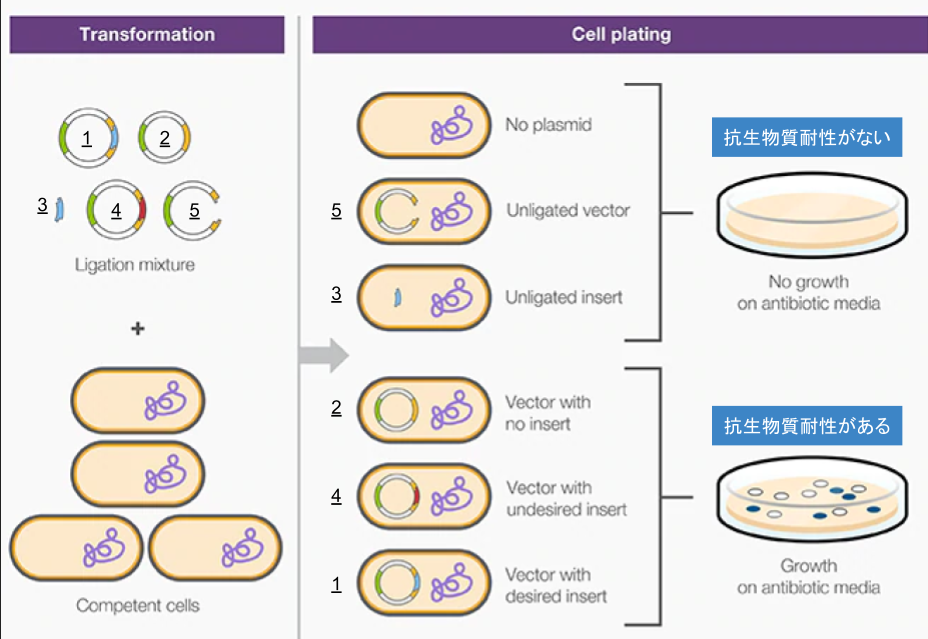
何らかのDNAフラグメントをプラスミドベクターに挿入する際、プラスミドベクターと挿入したいDNAフラグメントを制限酵素処理し、ライゲーションを行います。重要なのは、目的のDNAフラグメントがプラスミドベクターにすべて正しく挿入されるわけではないということです。
図1の左上は、プラスミドベクターと挿入するDNAフラグメントの組み合わせです。水色が挿入したいDNAフラグメントです。
出典:Thermo Fisher Scintific, クローニングの基礎知識.に筆者追記
ライゲーション後に形成されるプラスミドベクターと挿入するDNAフラグメントは、以下の5パターンの組み合わせがあります。番号は図中と対応しています。
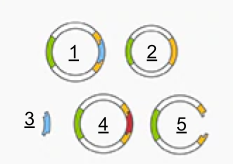
- プラスミドベクター+目的のDNAフラグメント(水色):成功
- プラスミドベクターのみでライゲーションあるいは未切断
- DNAフラグメントのみ
- プラスミドベクター+意図しないDNAフラグメント(赤色)
- ライゲーションなし
2-5番はすべて意図しない組み合わせですが、コンピテントセルはこれら組み合わせも取り込みます。これら組み合わせに、何も導入されなかったコンピテントセルを加えると、以下の6パターンのコンピテントセルが生じることになります。

何も導入されなかった“No plasmid”と5番と3番は、プラスミドベクターが機能しないため、抗生物質耐性を獲得できません。そのため、抗生物質を含む培地で培養すれば除外できます。
一方、2番と4番と1番は、抗生物質耐性を獲得するため、抗生物質入りの培地で培養しても、3種類とも増殖を続けます。本来、欲しい形質転換細胞は、目的のDNAフラグメントが正しく挿入された1番のみです。このまま培養を続けてコロニーをピックアップすると、不要な2番と4番も紛れ込んでしまいます。
そこで、ブルー・ホワイトセレクションで更なる絞り込みをします。ブルー・ホワイトセレクションは、「抗生物質セレクションで除けない不要な2番」と「目的の1番」を染色によって区別する手法です。
「4番」はどこにいったのかと思われたと思います。残念ながら「意図しないDNAフラグメントが挿入された4番」と「目的の1番」をブルー・ホワイトセレクションで区別することはできません。その理由は、以下の原理を理解すれば納得できます。
ブルー・ホワイトセレクション(青白選択)の原理
LacZがX-Galを分解して青色に発色する
ブルー・ホワイトセレクション(青白選択)に使用するプラスミドベクターには、lacZ α遺伝子の配列があり、その配列の途中にマルチクローニングサイト(Multi cloning site; MCS)があります。
ライゲーションの際は、lacZ α遺伝子配列の途中のマルチクローニングサイトを制限酵素で切断し、そこへ目的のDNAフラグメントを挿入します。
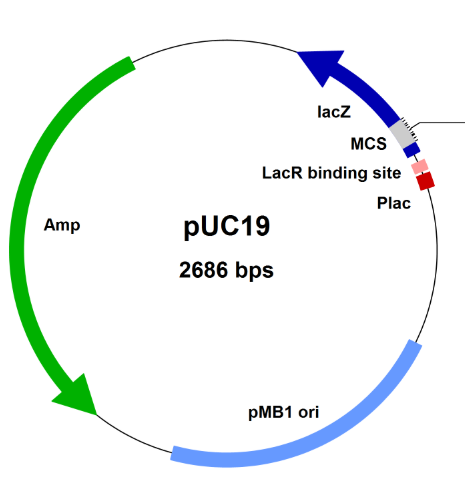
出典:Boca Scientific, Standard Cloning Vector pUC19
lacZ α遺伝子は、βガラクトシダーゼのαフラグメントをコードし、βガラクトシダーゼはX-Gal(5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside)を分解します。X-Galが分解されると青色の5-ブロモ-4-クロロ-インドキシルが発生します。
つまり、lacZ α遺伝子が正常に機能すると、形質転換細胞は青色になり、lacZ α遺伝子が機能しない場合、形質転換細胞は白色になります。
図1で説明すると、「マルチクローニングサイトに何も挿入されていないプラスミドベクターを取り込んだ形質転換細胞」(図1の2番)は、青色になり、「マルチクローニングサイトにDNAフラグメントが挿入されたプラスミドベクターを取り込んだ形質転換細胞」(図1の1番と4番)は白色です。
また、X-Galと一緒に添加されるIPTG(Isopropyl β-D-1-thiogalactopyranoside)は、βガラクトシダーゼの発現を誘導する作用があります。
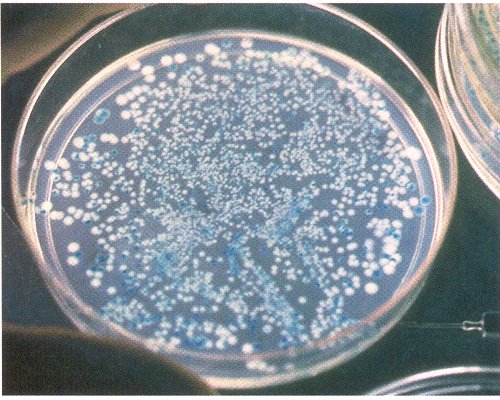
もうひとつの仕掛け:lacZΔM15(M15欠損)大腸菌を使う
lacZ α遺伝子が機能することでβガラクトシダーゼが発現し、X-Galが分解されると述べましたが、ここにはもうひとつの仕掛けがあります。
というのも、通常の大腸菌は、プラスミドベクターを取り込まずとも、βガラクトシダーゼを発現しているからです。そのため、通常の大腸菌をブルー・ホワイトセレクションに使うと、lacZ α遺伝子の途中にDNAフラグメントが挿入されていてもいなくても、βガラクトシダーゼがX-Galを分解し、すべて青色のコロニーを形成します。
これではブルー・ホワイトセレクションは成立しません。そこで、ブルー・ホワイトセレクションでは、lacZΔM15(M15欠損)大腸菌を使います。この大腸菌は、活性を持つβ-ガラクトシダーゼを単独では発現できず、プラスミドベクター側が持つLacZαと共存して初めて活性のあるβ-ガラクトシダーゼを発現できます。
これにより、lacZ α遺伝子の途中にDNAフラグメントが挿入されたプラスミドベクターを取り込んだ形質転換群のみがX-Galを分解できず、白色のコロニーを形成します。

挿入されたDNAフラグメントが目的のものか確認
「意図しないDNAフラグメントが挿入された4番」と「目的の1番」をブルー・ホワイトセレクションで区別することはできないと述べました。形質転換細胞のプラスミドベクターに挿入されたDNAフラグメントが目的のものであるか確認するには、コロニーPCRを行います。コロニーPCRについては別の機会に紹介したいと思います。
ブルー・ホワイトセレクション(青白選択)の原理を動画で学ぶ
以下はYouTubeで紹介されているブルー・ホワイトセレクションの動画です。
ブルー・ホワイトセレクション(青白選択)に必要な試薬
- X-Gal(5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside, CAS No. 7240-90-6)
- Dimethylformamide (DMF, CAS No. 68-12-2)
- 滅菌水
- IPTG(Isopropyl β-D-1-thiogalactopyranoside, CAS No. 367-93-1)
- 抗生物質
- 培地
試薬の調製
20 mg/mL X-Gal溶液の作り方
- 200mgのX-Galを15mLチューブに入れます。
ポリプロピレン製のチューブを推奨します。 - そこへ10mLのDMFを加え、ボルテックスでX-Galを溶解します。
- 1mLチューブに小分けします。
チューブをアルミホイルで遮光し、-20℃で保管します。数か月は保管可能です。
100mmol/L IPTG溶液の作り方
- 238mgのIPTGを15mLチューブに入れます。
- そこへ10mLの滅菌水加え、ボルテックスでIPTGを溶解します。
- ポアサイズ0.2μmのフィルターを通し、滅菌します。
- 1mLチューブに小分けします。
-20℃保管で1年間は保管可能です。
X-Gal染色のプロトコル
X-GalとIPTGを寒天培地に混ぜる場合
- 寒天培地をオートクレーブした後、50℃に冷まします。
- 寒天培地1mLに対し、10μLの20mg/mL X-Gal溶液を加えます。
100mg/mL X-Gal溶液を使用する場合は、寒天培地1mLに対して2μLを加えます。 - そこへ、10μLの100mmol\L IPTG溶液を加えます。
終濃度1mmol/Lです。 - 選抜用の抗生物質溶液を添加します。
- プレートに注ぎ、室温になるまで静置します。
すぐに使わない場合は4℃で遮光保管します。1週間程度は保管できます。 - 形質転換後のコンピテントセルを播種します。
- 37℃でインキュベーションします。
通常、24時間以内に青色コロニーが生じます。
X-GalとIPTGを寒天培地に混ぜない場合
- 抗生物質を含む寒天培地をプレートに注ぎ、クリーンベンチ内で乾燥させます。
- 40µLの100mmol/L IPTG溶液と120µLの20mg/mL X-Gal溶液をプレートの表面に添加します。培地表面全体に行き渡るようにします。
- そのままクリーンベンチ内に静置し、乾燥させます。
少なくとも30分間程度は静置しておきます。 - 形質転換後のコンピテントセルを播種します。
- 37℃でインキュベーションします。
通常、24時間以内に青色コロニーが生じます。
参考文献
Boca Scientific, Standard Cloning Vector pUC19.
Gold Biotechnology, Blue-White Screening of Bacterial Colonies.
Steven M. Carr, Colony plating test for successful DNA recombination.
Thermo Fisher Scintific, クローニングの基礎知識.







コメントを残す