本記事は以下の論文を翻訳したものです。
Clotilde Théry(2011)Exosomes: secreted vesicles and intercellular communications, F1000 Biology Reports, DOI:10.3410/B3-15, open access at http://f1000.com/reports/b/3/15.
エクソソーム研究の歴史、問題点、期待の概要がまとめられています。
要約

エクソソーム(Exosome)は、ほとんどの細胞から分泌されるエンドサイトーシスを起源とするの小さなメンブレンベシクル(膜小胞)であり、細胞間コミュニケーションで重要な役割を果たすと考えられている。 エクソソームはもともと1983年に報告されていたが、これらのベシクルの研究は、mRNAとmicroRNAを含むことがわかった後の3年間で劇的に増加した。 この発見は、細胞間コミュニケーションの研究者の新たな関心を呼び起こし、これらベシクルの構造に関する研究は、過去数年にわたって指数関数的に増え、その構成分子と生理機能は現在も研究され続けている。また、基礎研究のみならず、エクソソームを対象とした疾患バイオマーカーの発見も期待されている。
背景:エクソソームの発見と注目される理由

エクソソーム(exosomes)として知られるベシクル(vesicles)は、約30年前に初めて発見された。当時、エクソソームは細胞に不要な分子を廃棄するゴミ箱にすぎないと考えられており、その後の10年間はほとんど研究されていなかった。しかし、数年にわたって、ベシクルは細胞由来のタンパク質、脂質、遺伝子を含み、 他の細胞の生理機能を変えるシグナル伝達ペイロードのような役割が報告がされてきた。この新たな発見は、エクソソームへの関心を再燃させた。エクソソームという名称を使うかどうかに関わらず、ベシクルは細胞間コミュニケーションの研究分野で注目されるようになった。
2年前、エクソソームに関する記事、出版物再版のリクエスト、エクソソーム関連プロトコルの詳細、ベシクルの精製方法と機能評価などに関するメールを毎日受け取るようになった。この分野で10年以上研究していたので、私はこのテーマに取り組んでいる他のすべての研究者を知っていると思っていたが、これまで聞いたことのない研究グループからのリクエストが来ていました。あまりに多くの問い合わせが来たため、ベシクル研究の分野が成長していることを実感した。
文献をざっと見てみると細胞外小胞研究分野の成長を確認できる。「エクソソーム」という言葉を使用したPubMedの論文数は、2003年初頭に20未満、2007年には60を超え、過去3年間だけで約350のエクソソーム研究論文が報告された。
この成長を背景に、1996年に免疫抗原提示細胞からエクソソームを発見したGraça Raposoと私で、エクソソームに関するInternational Workshop on Exosomes(IWE)を開催するようになった。また、 1983年にエクソソームについて最初に報告をした故Rose Johnstoneが主催した2005年の会議では、カナダのモントリオールに25人の科学者が集まった[1]。パリのキュリー研究所には、そのほぼ10倍の参加者が集まった。そこでは、免疫学から神経生物学、腫瘍生物学に至るまでの多様な分野の研究者が、エクソソームや細胞外小胞に関する最近の発見、ならびにバイオマーカーや治療ツールなどの潜在的な臨床応用についての議論をした。
多細胞生物では、細胞はヌクレオチド、脂質、短いペプチド、タンパク質などの細胞外分子を介して他の細胞とコミュニケーションを行う。これらの分子は細胞から細胞外に放出され、他の細胞の受容体に結合し、生理学的変化をもたらす。しかし、これらの単一分子に加えて、真核細胞は細胞外へ膜小胞と呼ばれる複雑な構造をもった粒子も放出する。膜小胞には、多数のタンパク質、脂質、さらには核酸が含まれており、ベシクルを受容するレシピエント細胞に複雑な影響を与える可能性がある。
メンブレンベシクル(Membrane vesicles)は、数十年にわたって存在することが知られていたが(例えば、血液中の「microparticles」、精液中の「prostasomes」[2])、単なる細胞の残骸、細胞死の兆候、特定の器官の分子と長い間考えられていた。ここ10年間でエクソソームなどメンブレンベシクルを細胞間コミュニケーションツールとして考えるようになった。
エクソソームは、分泌されたメンブレンベシクルの特定のサブタイプを表現する(reviewed in [3])。エクソソームは、膜結合構造に分子をパッケージングする内部小胞を含む、多胞性エンドソームと呼ばれるエンドソーム画分に形成される。
エンドソームは一般に、細胞外分子のエンドサイトーシスが起こる細胞膜と、これらの分子が放出および分解されるコンパートメント(リソソーム)の間の中間コンパートメントとして機能すると考えらる。しかし、約25年前、米国のPhilip Stahl [4]とカナダのRose Johnstone [5]のグループは、パルス追跡および電子顕微鏡実験を使用し、網状赤血球で、多胞性後期エンドソームは(リソソームの代わりに)原形質膜と再融合し、多数の小さな小胞を含むその内容物を細胞外に放出することを報告した。
1987年に、これらの細胞外に放出されたエンドソーム内小胞を定義するために「エクソソーム」という用語が提案された[6]。
その後の10年間、エクソソームはほとんど注目されたなかったが、 Raposoと Hans Geuzeが1996年に Epstein–Barr virus (EBV) 形質転換Bリンパ球がエクソソームを分泌し、そのエクソソームが適応免疫反応、すなわち主要組織適合性クラス(MHC)II二量体の抗原ペプチドへの結合に重要であることを報告した[7]。さらにその2年後、Raposo、AmigorenaおよびZitvogelのグループ[8]は、樹状細胞(MHC-ペプチド複合体をナイーブT細胞に提示することにより適応免疫応答を開始する免疫細胞)もMHC-ペプチド複合体を保持するエクソソームを分泌することを示した。この研究は、in vivoでマウスの抗腫瘍免疫応答の誘導を促進する可能性を示唆している。
これらの結果は、エクソソームが少なくとも免疫系において細胞間コミュニケーションに積極的な役割を果たすという仮説をもたらし、ヒトにおける新しいがん療法としてクリニックで臨床応用されるきっかけになりました(1999年から2002年にかけて行われたフェーズIの試験の後、 Gustave Roussy Instituteと Curie Instituteによって、フェーズIIの試験が現在進行中[9])
その後数年の最初の大きな進歩は、大規模なタンパク質分析技術の開発に関連しており、エクソソームが単なる細胞の残骸ではなく特定の細胞内コンパートメントであることを示した。

エクソソームの最初のプロテオーム解析は、樹状細胞から分泌されたエクソソームで行われ[10,11]、次にExoCartaでまとめられているように多種の細胞のエクソソームで行われた[12]。これらの研究は、エクソソームが細胞内タンパク質を無作為に含んでいるのではなく、細胞膜、エンドサイトーシス経路、およびサイトゾルに由来するいくつかのタンパク質ファミリーの特定のセットを含んでおり、一方で他の細胞内コンパートメント由来のタンパク質の量が非常に少ないことを示した。例えば、核、小胞体、ゴルジ体、アポトーシス細胞によって放出されたメンブレンベシクルとエクソソームとでは、含まれるタンパク質の構成が明らかに異なった。これらの結果は、エクソソームが生細胞によって積極的に分泌されること、またエンドソーム内が起源であることを示した。
さらに、組織培養(免疫細胞だけでなく上皮細胞および腫瘍細胞)からin vitroで精製されたエクソソームの研究により、ある細胞から分泌されたエクソソームが別の細胞に取り込まれ、情報を伝達できることが示され始めた。伝達される情報には、抗原提示細胞の範囲と免疫応答の誘導効率を高めるための抗原またはMHC-ペプチド複合体[13-15]、場合によっては標的細胞の死につながるシグナル[16]が含まれている。
これらの結果は、エクソソームが新しい細胞間メッセンジャーであるという考えの礎になった。
2番目のブレークスルーは2007年で、スウェーデンのJanLötvallのグループによる報告だ。彼らは、細胞外小胞内にmRNAおよびmicroRNA(miRNA)が存在することを示した[17]。さらに、彼らは濃縮エクソソームをin vitroで使用し、エクソソームに存在する一部のmRNAがレシピエント細胞のタンパク質に翻訳されることを示し、エクソソームが遺伝情報を伝達できることを示唆した。この発見と、miRNAに関する研究の同時進行により、エクソソームに関する論文数が指数関数的に増加した。
2011年1月、 International Workshop on Exosomes(IWE) 2011での口頭およびポスター発表は、免疫学、細胞生物学、バイオマーカーとしての使用、腫瘍との関係に及ぶエクソソーム研究の現在探求されているすべての分野をカバーしていた。
この会議から得たの私の主要な結論は以下の4つである。
(a)エクソソームは、細胞間メッセンジャーとして機能する唯一の分泌膜小胞ではない。
(b)今後数年間は、循環小胞(エクソソームまたはその他)のRNAおよびmiRNAがさまざまな疾患の有用なバイオマーカーであるかどうかが研究され、新しい診断または予後の検査ツールになり得る。
(c)元々は免疫系の細胞で説明されていたが、エクソソームは免疫細胞に限らず多くの細胞種によって分泌される。腫瘍形成過程において、幹細胞、神経系エクソソームがメッセンジャーとして機能する可能性を示している。また、病原体と宿主の相互作用のメッセンジャーとして機能する。
(d)過去30年間でエクソソームの知識が大きく増加したが、in vivoにおける明確な生理機能は不明である。生理機能を実証することは、この分野の大きな課題である。
エクソソームと他のメンブレンベシクルの違い
「エクソソーム」とは、細胞内の多胞性コンパートメントに形成され、原形質膜と融合して放出される分泌膜小胞(Secreted membrane vesicles)を指す(Figure 1)。
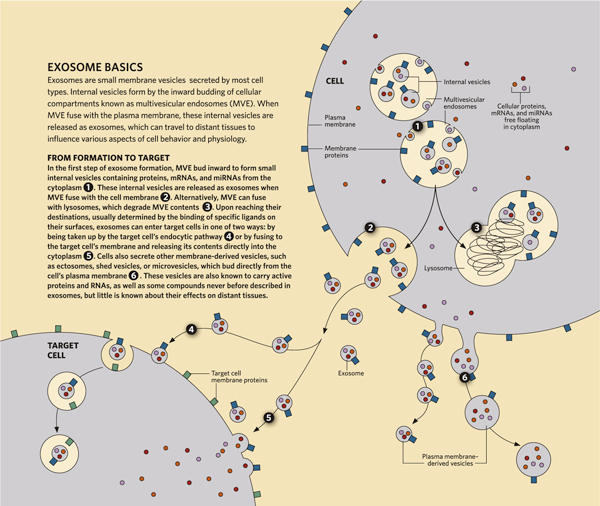
エクソソームは、多胞性コンパートメントの細胞内小胞とサイズが似ており、直径は約100 nmである。エクソソームは通常、サイズに基づいて遠心分離によって精製され、最終的に100,000 gの超遠心分離でペレットとして単離される。 ただし、この精製は絶対的なものではない。例えば、一部の細胞では細胞膜から直接小胞が発生し、細胞の外へ放出される。このような小胞のサイズは、直径は50〜1,000 nmで 、エクソソームのサイズほど厳密には定義されていない。これらの小胞には、「エクトソーム(ectosomes)」[18]、「shed vesicles」、「マイクロベシクル(micro vesicles)」などのさまざまな用語が使用されている。 マイクロベシクルという単語は、細胞内または細胞外を問わず、また細胞内の発生起源を問わず使用される。
大きな原形質膜由来の小胞の放出は、腫瘍細胞へ新鮮なウシ胎児血清[19]、補体沈着、好中球内の細胞内Ca2 +の増加[20]などの刺激後に急速に誘導される。
ベシクルは、異なる速度の超遠心分離でサイズによって分けるができ、大きな小胞は小さな小胞よりも低い超遠心速度でペレットとなる。しかし、超遠心分離法は、小胞の起源別に分離することはできない。すなわち、小胞のサイズが同じエクソソームと他の小さな原形質膜由来のベシクルは、超遠心分離では区別することができない。ショ糖勾配法で密度の異なる小胞をある程度分離できるが、この分離も完全ではない。
細胞によって分泌される小胞の種類を区別するための適切な方法は、まだ確立してはいない。
マイクロベシクルおよびエクトソームのプロテオーム研究は、エクソソームほどは行われていないが、進行中であり、分泌小胞の特徴を理解する助けになる。 エクソソームと同様、マイクロベシクルとエクトソームには、サイトカイン、成長因子の受容体、RNAなどのさまざまな活性分子、およびメタロプロテアーゼが含まれている。今後数年で各タイプの小胞の機能的特徴が明らかになるだろう。
メンブレンベシクルに含まれるRNAおよびmicroRNA

2007年のエクソソーム由来RNAの同定と核酸分析のためのハイスループット技術の開発以来、エクソソーム由来RNAを報告する研究が増え続けている。これらの研究から、細胞内に存在するすべてのメッセンジャーRNA(mRNA)がエクソソームに内包されるのではなく、特定のmRNAが内包され、細胞外へ放出されていることがわかった[17]。ここ数年の研究結果から、エクソソームに内包されるmRNAは、単に死細胞が細胞外へ放出したランダムなmRNAではないことを示唆している。
しかしながら一方で、細胞種を問わないエクソソーム由来固有のmRNAおよび細胞特異的なエクソソーム由来mRNAを発見したという報告はほとんどなく、そのようなmRNAが存在するかは不明である。ここ数年の研究結果から、エクソソームに内包されるmRNAは、単に死細胞が細胞外へ放出したランダムなmRNAではないことを示唆している。しかしながら一方で、細胞種を問わないエクソソーム由来固有のmRNAおよび細胞特異的なエクソソーム由来mRNAを発見したという報告はほとんどなく、そのようなmRNAが存在するかは不明である。
mRNAがベシクルに内包されるメカニズムを理解できれば、ベシクルを使ってmRNAをデリバリーする意味を理解するのに繋がるだろう。
特筆すべきこととして、腫瘍細胞や幹細胞由来のマイクロベシクルにmRNAが含まれ[21-23]、エクソソームとラージベシクルそれぞれに内包されるmRNAを比較し、それらに明確な違いがあるかを調べる研究がまさに進められている。
エクソソーム由来miRNAについては、mRNAよりも状況はさらに複雑である。様々なエクソソームでmiRNAは観察されているが、miRNA配列を特定するための技術が一貫しておらず、エクソソーム由来特異的なmiRNAがあるかは不明のままである。加えて、薬剤を使ってmiRNAの細胞外への放出を減少させる報告があるが、これらの研究では、フリーmiRNAやタンパク質結合miRNAが、エクソソームまたはベシクルに内包されたmiRNAと比較して、どの程度意味があるのかわからない。
mRNAおよびmiRNAを運ぶベシクルの性質は明らかではないが、バイオ産業では、分泌されたベシクル、特に特定のmRNAおよびmiRNAの量を疾患バイオマーカーとして精力的に研究してきた。ベシクルに内包されたRNAは、分解されにくく、血漿、尿、牛乳、精子、唾液などの体液からの効率的な回収できるため、フリーのRNAを調べるより比較的容易である。
実際、様々な研究チームが正常細胞とがん細胞、正常検体と疾患検体から単離されたベシクルに含まれるRNAやタンパク質を比較している。現時点では、診断、予後、治療方針決定に使用できるバイオマーカーを提案するには時期尚早と言えるが、精力的に研究されているため、今後数年でそのようなマーカーが存在するのか明らかになるだろう。
報告されているエクソソームの機能
細胞外へ分泌されたメンブレンベシクルは、周囲の細胞と相互作用する。多くの蛍光顕微鏡を使った研究では、ベシクルが補足され、エンドサイトーシスまたは貪食により細胞内部に蓄積される様子が観察されている。特にマクロファージなどの貪食細胞ではよく報告される。
なお、直径200 nm未満のベシクルの観察には留意する必要がある。それは、共焦点顕微鏡ではエクソソームを検出できず、エクソソームの詳細な可視化は電子顕微鏡法でのみ可能であることだ。ベシクルの研究は共焦点顕微鏡を用いたものが多く、したがって、個々のベシクルがレシピエント細胞と相互作用する仕組みはまだ明らかになっていない。現在のところ、レシピエント細胞の受容体を介した細胞表面での結合、エンドサイトーシスまたはミクロピノサイトーシスによる取り込み、原形質膜または細胞内部の膜との融合による取り込みが提案されている。
特定の条件下で膜融合による取り込みが起こるという報告もある[24]。この研究では、レシピエント細胞の細胞膜でエクソソーム表面の脂質が分解されることを示しており、エクソソームが内包する分子(RNAなど)をレシピエント細胞のサイトゾルへどのように放出されるのかを明らかにした。
エクソソームの機能に関して、エクソソームは、レシピエント細胞の生理的変化をもたらす。元々、エクソソームの研究対象は免疫細胞であったため、エクソソームの免疫学的意味に関するデータはたくさんある。それらデータからエクソソームの機能は、エクソソームを分泌するドナー細胞の生理学状態に応じて大きく異なることが示されている(参考文献[9]を参照)。
1つ目の例として、成熟した樹状細胞は、抗原またはMHC-ペプチド複合体を含有するエクソソームを分泌し、他の樹状細胞による抗原特異的免疫応答を誘導する(特に抗がん療法研究において研究される)。それとは逆に、2つ目の例ととして、免疫応答を抑制するよう処理された樹状細胞、または免疫抑制性サイトカインを発現するようにした樹状細胞は、免疫寛容を誘導するエクソソームを分泌する。これは自己免疫疾患の治療に有用になる可能性がある。3つ目の例として、マイコバクテリアに感染したマクロファージは、マイコバクテリアの株に応じて異なるエクソソームを分泌する。非病原性マイコバクテリアに感染したマクロファージは、免疫応答を促進するエクソソームを放出する。病原性マイコバクテリアに感染したマクロファージは、マクロファージの活性化とサイトカイン分泌を阻害するエクソソームを分泌し、免疫応答を減衰させる。
腫瘍細胞によって分泌されたエクソソームは、腫瘍細胞から抗原を運び、樹状細胞に抗原を提示する。他方で、腫瘍細胞由来エクソソームは、免疫応答を抑制する分子も含み、T細胞やナチュラルキラー細胞の不活性化をもたらす。制御性T細胞やミエロイド細胞の分化を促進するのである。
このように矛盾した作用を持つエクソソームが、体内でどのような意味を持つか不明であるが、様々な研究グループが、腫瘍細胞が分泌するエクソソームには、抗腫瘍免疫応答を阻害する作用、血管新生または腫瘍転移を促進する作用、腫瘍の成長を促進する作用があると報告している。
患者の血液からのメンブレンベシクル除去は癌治療法として使用できることが示唆されているが[25] 、注意しなければならないのは、このような研究において、腫瘍由来エクソソームやメンブレンベシクルが生体内でどのような機能を果たしているのか十分に考えられていないことである。腫瘍由来のメンブレンベシクルは、腫瘍の進行に関与しているのではなく、単に腫瘍の拡大の結果としてそれらメンブレンベシクルが発生していると言うこともできる。
免疫抑制分子を持つするエクソソームに関して、ナチュラルキラーリンパ球のリガンドを持つ胎盤由来ベシクルが、妊婦の血液から発見されている。このベシクルが胎児に対する母親の免疫耐性に関与しているか調べるため、ベシクルの内包物の解析が進められている。
気管支肺胞洗浄液に存在するエクソソームを含むベシクルは、免疫寛容を誘導する分子が含まれていると言われている(例えば免疫寛容化マウスにおいて)。
逆に、ヒトの喘息患者においては、気道上皮細胞による炎症誘発性サイトカインの分泌を増加させる。
寄生虫(Leishmania major)または病原体(真菌など)によるエクソソームの分泌も近年報告されている。寄生虫由来のエクソソームは、ホストの免疫応答を弱めることにより、寄生虫に対するホストの免疫寛容を促進している、あるいは逆に、病原体に対するホストの炎症反応を誘発していると考えられている。
免疫系だけではなく、エクソソームはおそらく他の生理機能にも影響を及ぼしている。 エクソソームは、神経、上皮、筋肉、および幹細胞から分泌され、報告されているそれらの機能は多岐に渡る。間葉系幹細胞由来エクソソームは、心臓の組織修復に寄与し、逆に、肺は、幹細胞の肺上皮細胞への分化を促進するエクソソーム(または他のベシクル)を放出する[26,27]。 エクソソームは、神経系内のコミュニケーションにも貢献し、エクソソームは、神経系内のコミュニケーションにも関与する。エクソソームはニューロン、乏突起膠細胞、およびミクログリアによって分泌され、各エクソソームは他の神経細胞に影響を与える可能性がある[28-30]。また、エクソソームは、病原性タンパク質(プリオンやアミロイド蓄積など)の形成、移動に関与している[31,32]。これら以外のエクソソームの機能も今後報告されるだろう。
エクソソームの生理機能:in vivo
ここまでで述べた研究報告は、in vitroで実験された研究、もしくはin vivoであっても細胞培養上清あるいは体液からin vitroで精製および濃縮されたベシクルを使用している。したがって、これらのエクソソームなどベシクルの作用が生体内で発生するかどうかは不明である。主な問題は、 エクソソームなどベシクル の精製および定量方法が妥当であるかわらないことである。超遠心分離では、ある時点で分泌されたベシクルを100%回収することはできず、分泌されたベシクルの一部は、培地または体液へ放出されるのではなく、細胞によって捕捉されるため、精製することさえできない。in vitroの実験で使用されるベシクルの量が、生体内で分泌されるベシクルの量と比べて適切であるか判断することは非常に困難である。実際、エクソソーム研究分野では、エクソソームが生体内で実際に何らかの生理学的機能を持っているかどうかは疑問が残っている。
この疑問に答えるには、エクソソーム以外のベシクルの分泌に影響を与えたり、タンパク質や脂質メディエーターの分泌に影響を与えたりすることなく、エクソソームの分泌を特異的に抑制または増加させるツールが必要である。いくつかの研究グループは、特に多胞コンパートメントの細胞内小胞の形成、およびこれらのコンパートメントと細胞膜の融合に関与する分子メカニズムを明らかにすることにより、そのようなツールを開発しようとしている。エクソソーム分泌に影響する分子が存在することは示されているが、多胞性エンドソームと原形質膜の融合をリアルタイムで視覚化および定量化する手段がないため、それら分子がどのようにエクソソームの分泌に関与しているかは明確でない。
関与する分子のメカニズムについて今だ共通見解はなく、エクソソームの合成と分泌に関わる分子は細胞種によって異なる。例えば、赤白血病細胞株のRab11 [33]、Hela細胞のRab27 [34]、および乏突起膠細胞のRab35および中性スフィンゴミエリナーゼ[35,36 ]である。これらの分子の不一致は、細胞種によるベシクルの分泌のメカニズムに違いによるものなのか、あるいは異なる細胞内の発生起源によるものなのかはわかっていない。
最近の研究は、ある条件下において、多胞性エンドソームを起源とする細胞内部のベシクルは、ESCRT(endosomal sorting complex required for transport)のメカニズム(酵母おける後期エンドソームの細胞内ベシクルへ分子が分離される機構として説明される)を利用することなく形成されることを示している。この事実は、当初考えられていたよりも多種類の多胞性コンパートメントが細胞内に存在し、それらが多様なエクソソームを発生させている可能性を示唆している。
いずれにせよ、エクソソームの分泌に影響を与える分子を調べるには、それぞれの分析モデルにおいて、エクソソームや他の分泌物の影響を慎重に評価しなければならない。
パリで行われたミーティングにおいて、生体内のエクソソームの生理的機能を調べる他の複数のアプローチが提案された。それは、1. 特定の機能性タンパク質の発現を変えたエクソソームを生成させ、機能的な変化を解析する方法、2. バクテリアの酵素をエクソソームに内包させ、酵素活性を測定することでレシピエント細胞を特定する方法であった。次のステップとして、遺伝子組み換えマウスとこれらのアプローチを組み合わせる研究が行われるだろう。
パリでの会議中に提案された生体内のエクソソームの生理学的機能に対処する他のアプローチには、特定の機能性タンパク質の発現を変更したエクソソームの生成と機能結果の分析、または酵素活性の測定による標的細胞の同定のための細菌酵素の含有が含まれます。遺伝子組み換えマウスでこれらのアプローチを使用することは、この挑戦的な分野の次のステップです。
最後に、エクソソームではない他のメンブレンベシクルの生成に関する同様の研究も進行中であり、種々のベシクルの役割が明らかなることが期待される。
結論
過去3年間において、エクソソームに関する研究の数が驚くほど増えた。メンブレンベシクルの分泌機構とその細胞間メッセンジャーとしての役割に関する研究は、非常に刺激的な分野であり、新しいアイデア、仮説、疑問が次々に生まれている。
パリで開催されたIWE(International Workshop on Exosome)では、長年に渡ってエクソソームとベシクルを研究してきた古参者と新たな新参者とが自由に会い、アイデアを出し合い、技術や定義、特性に関する現在の問題を指摘しあった。
会議では、今後の年次総会の開催、議論を記録するためのウェブサイトやFacebookページなどの作成、エクソソームとメンブレンベシクルに特化した協会を設立することが決定され、この生産的なワークショップを継続することになった。決定事項のいくつかはすでに進行中で、次のIWEは2012年4月に暫定的に予定されている。Facebookページも既に運用され[37]、エクソソームのタンパク質とRNAの比較用のWebサイト[38]は近日公開である。この記事の読者は、これらのWebリンク[37,38]をチェックし、この新しい科学の世界の次のステップに参加してほしい。
引用文献
| 1 | Couzin J: Cell biology: The ins and outs of exosomes. Science. 2005, 308:1862–3.PubMed | CrossRef |
| 2 | Ronquist G, Brody I: The prostasome: its secretion and function in man. Biochim Biophys Acta. 1985, 822:203–18.PubMed | CrossRef |
| 3 | Théry C, Ostrowski M, Segura E: Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 2009, 9:581–93.PubMed | CrossRef |
| 4 | Harding C, Heuser J, Stahl P: Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. J Cell Biol. 1983, 97:329–39.PubMed | CrossRef |
| 5 | Pan BT, Teng K, Wu C, Adam M, Johnstone RM: Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. J Cell Biol. 1985, 101:942–8.PubMed | CrossRef |
| 6 | Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C: Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987, 262:9412–20.PubMed | CrossRef |
| 7 | Raposo G, Nijman HW, Stoorvogel W, Liejendekker R, Harding CV, Melief CJ, Geuze HJ: B lymphocytes secrete antigen-presenting vesicles. J Exp Med. 1996, 183:1161–72.PubMed | CrossRef |
| 8 | Zitvogel L, Regnault A, Lozier A, Wolfers J, Flament C, Tenza D, Ricciardi-Castagnoli P, Raposo G, Amigorena S: Eradication of established murine tumors using a novel cell-free vaccine: dendritic cell-derived exosomes. Nat Med. 1998, 4:594–600.PubMed | CrossRef |
| 9 | Chaput N, Théry C: Exosomes: immune properties and potential clinical implementations. Semin Immunopathol. 2011 [Epub ahead of print].PubMed | CrossRef |
| 10 | Théry C, Boussac M, Véron P, Ricciardi-Castagnoli P, Raposo G, Garin J, Amigorena S: Proteomic analysis of dendritic cell-derived exosomes: a secreted subcellular compartment distinct from apoptotic vesicles. J Immunol. 2001, 166:7309–18.PubMed |
| 11 | Théry C, Regnault A, Garin J, Wolfers J, Zitvogel L, Ricciardi-Castagnoli P, Raposo G, Amigorena S: Molecular characterization of dendritic cell-derived exosomes. Selective accumulation of the heat shock protein hsc73. J Cell Biol. 1999, 147:599–610.PubMed | CrossRef |
| 12 | Mathivanan S, Simpson RJ: ExoCarta: A compendium of exosomal proteins and RNA. Proteomics. 2009, 9:4997–5000.PubMed | CrossRef |
| 13 | Théry C, Duban L, Segura E, Véron P, Lantz O, Amigorena S: Indirect activation of naïve CD4+ T cells by dendritic cell-derived exosomes. Nat Immunol. 2002, 3:1156–62.PubMed | CrossRef |
| 14 | Wolfers J, Lozier A, Raposo G, Regnault A, Théry C, Masurier C, Flament C, Pouzieux S, Faure F, Tursz T, Angevin E, Amigorena S, Zitvogel L: Tumor-derived exosomes are a source of shared tumor rejection antigens for CTL cross-priming. Nat Med. 2001, 7:297–303.PubMed | CrossRef |
| 15 | Karlsson M, Lundin S, Dahlgren U, Kahu H, Pettersson I, Telemo E: “Tolerosomes” are produced by intestinal epithelial cells. Eur J Immunol. 2001, 31:2892–900.PubMed | CrossRef |
| 16 | Andreola G, Rivoltini L, Castelli C, Huber V, Perego P, Deho P, Squarcina P, Accornero P, Lozupone F, Lugini L, Stringaro A, Molinari A, Arancia G, Gentile M, Parmiani G, Fais S: Induction of lymphocyte apoptosis by tumor cell secretion of FasL-bearing microvesicles. J Exp Med. 2002, 195:1303–16.PubMed | CrossRef |
| 17 | Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO: Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007, 9:654–9.PubMed | CrossRef |
| 18 | Stein JM, Luzio JP: Ectocytosis caused by sublytic autologous complement attack on human neutrophils. The sorting of endogenous plasma-membrane proteins and lipids into shed vesicles. Biochem J. 1991, 274:381–6.PubMed |
| 19 | Cassarà D, Ginestra A, Dolo V, Miele M, Caruso G, Lucania G, Vittorelli ML: Modulation of vesicle shedding in 8701 BC human breast carcinoma cells. J Submicrosc Cytol Pathol. 1998, 30:45–53.PubMed |
| 20 | Hess C, Sadallah S, Hefti A, Landmann R, Schifferli JA: Ectosomes released by human neutrophils are specialized functional units. J Immunol. 1999, 163:4564–73.PubMed |
| 21 | Skog J, Würdinger T, van Rijn S, Meijer DH, Gainche L, Sena-Esteves M, Curry WT, Carter BS, Krichevsky AM, Breakefield XO: Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers. Nat Cell Biol. 2008, 10:1470–6.PubMed | CrossRef |
| 22 | Baj-Krzyworzeka M, Szatanek R, Weglarczyk K, Baran J, Urbanowicz B, Branski P, Ratajczak MZ, Zembala M: Tumour-derived microvesicles carry several surface determinants and mRNA of tumour cells and transfer some of these determinants to monocytes. Cancer Immunol Immunother. 2006, 55:808–18.PubMed | CrossRef |
| 23 | Ratajczak J, Miekus K, Kucia M, Zhang J, Reca R, Dvorak P, Ratajczak MZ: Embryonic stem cell-derived microvesicles reprogram hematopoietic progenitors: evidence for horizontal transfer of mRNA and protein delivery. Leukemia. 2006, 20:847–56.PubMed | CrossRef |
| 24 | Parolini I, Federici C, Raggi C, Lugini L, Palleschi S, De Milito A, Coscia C, Iessi E, Logozzi M, Molinari A, Colone M, Tatti M, Sargiacomo M, Fais S: Microenvironmental pH is a key factor for exosome traffic in tumor cells. J Biol Chem. 2009, 284:34211–22.PubMed | CrossRef |
| 25 | Ichim TE, Zhong Z, Kaushal S, Zheng X, Ren X, Hao X, Joyce JA, Hanley HH, Riordan NH, Koropatnick J, Bogin V, Minev BR, Min WP, Tullis RH: Exosomes as a tumor immune escape mechanism: possible therapeutic implications. J Transl Med. 2008, 6:37.PubMed | CrossRef |
| 26 | Lai RC, Arslan F, Lee MM, Sze NS, Choo A, Chen TS, Salto-Tellez M, Timmers L, Lee CN, El Oakley RM, Pasterkamp G, de Kleijn DP, Lim SK: Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010, 4:214–22.PubMed | CrossRef |
| 27 | Quesenberry PJ, Aliotta JM: The paradoxical dynamism of marrow stem cells: considerations of stem cells, niches, and microvesicles. Stem Cell Rev. 2008, 4:137–47.PubMed | CrossRef |
| 28 | Potolicchio I, Carven GJ, Xu X, Stipp C, Riese RJ, Stern LJ, Santambrogio L: Proteomic analysis of microglia-derived exosomes: metabolic role of the aminopeptidase CD13 in neuropeptide catabolism. J Immunol. 2005, 175:2237–43.PubMed |
| 29 | Krämer-Albers EM, Bretz N, Tenzer S, Winterstein C, Möbius W, Berger H, Nave KA, Schild H, Trotter J: Oligodendrocytes secrete exosomes containing major myelin and stress-protective proteins: Trophic support for axons?Proteomics Clin Appl. 2007, 1:1446–61.PubMed | CrossRef |
| 30 | Lachenal G, Pernet-Gallay K, Chivet M, Hemming FJ, Belly A, Bodon G, Blot B, Haase G, Goldberg Y, Sadoul R: Release of exosomes from differentiated neurons and its regulation by synaptic glutamatergic activity. Mol Cell Neurosci. 2011, 46:409–18.PubMed | CrossRef |
| 31 | Fevrier B, Vilette D, Archer F, Loew D, Faigle W, Vidal M, Laude H, Raposo G: Cells release prions in association with exosomes. Proc Natl Acad Sci U S A. 2004, 101:9683–8.PubMed | CrossRef |
| 32 | Rajendran L, Honsho M, Zahn TR, Keller P, Geiger KD, Verkade P, Simons K: Alzheimer’s disease beta-amyloid peptides are released in association with exosomes. Proc Natl Acad Sci U S A. 2006, 103:11172–7.PubMed | CrossRef |
| 33 | Savina A, Fader CM, Damiani MT, Colombo MI: Rab11 promotes docking and fusion of multivesicular bodies in a calcium-dependent manner. Traffic. 2005, 6:131–43.PubMed | CrossRef |
| 34 | Ostrowski M, Carmo NB, Krumeich S, Fanget I, Raposo G, Savina A, Moita CF, Schauer K, Hume AN, Freitas RP, Goud B, Benaroch P, Hacohen N, Fukuda M, Desnos C, Seabra MC, Darchen F, Amigorena S, Moita LF, Théry C: Rab27a and Rab27b control different steps of the exosome secretion pathway. Nat Cell Biol. 2010, 12:19–30.PubMed | CrossRef |
| 35 | Trajkovic K, Hsu C, Chiantia S, Rajendran L, Wenzel D, Wieland F, Schwille P, Brügger B, Simons M: Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science. 2008, 319:1244–7.PubMed | CrossRef |
| 36 | Hsu C, Morohashi Y, Yoshimura S, Manrique-Hoyos N, Jung S, Lauterbach MA, Bakhti M, Grønborg M, Möbius W, Rhee J, Barr FA, Simons M: Regulation of exosome secretion by Rab35 and its GTPase-activaitng proteins TBC1D10A-C. J Cell Biol. 2010, 189:223–32.PubMed | CrossRef |
| 37 | Facebook Group – Exosomes, microvesicles and other secreted vesicles.http://www.facebook.com/#!/home.php?sk=group_171229582921487 |
| 38 | ExoCarta – Exosome protein and RNA database.http://exocarta.ludwig.edu.au/ |








コメントを残す