銀染色は、SDS-PAGE(タンパク質電気泳動)後のゲル中のタンパク質を染色する代表的な手法です。
銀染色はクマシーブリリアントブルー(CBB)染色よりも手間はかかりますが、数ngレベルのタンパク質を検出できるため、微量タンパク質を染色する際には欠かせません。
本記事では、質量分析に対応した銀染色の原理と銀染色プロトコルを紹介します。試薬の作り方も記載しています。通常のラボで購入できる試薬で作れます。
銀染色の原理
銀染色はたくさんの方法が報告され、使用する化合物も複数ありますが、いずれも以下の原理を利用しています。
- タンパク質を酢酸/エタノールで固定する。
このステップは、固定だけが目的ではなく、ゲル中の過剰なSDS(ドデシル硫酸ナトリウム)とグリシンを除去する意味もあります。SDSとグリシンは銀イオンが結合しやすいため、ここで除去しておくことで、ゲル全体のバックグラウンドを下げられます。 - 銀イオンをタンパク質に結合させる。
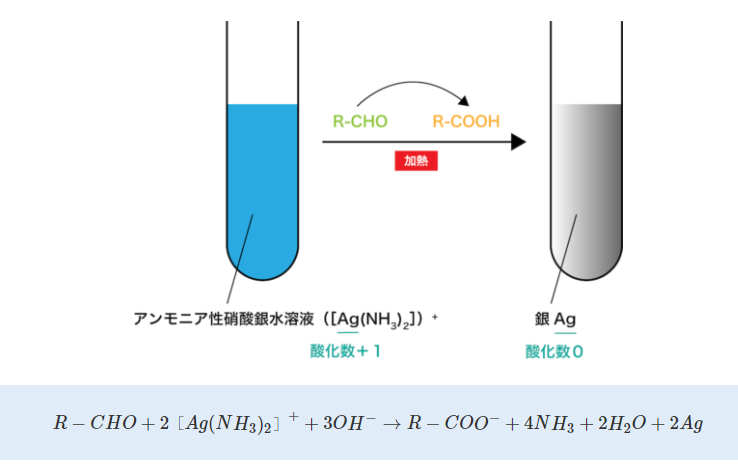
硝酸銀由来の銀イオン[Ag(NH3)2]+をゲル中のタンパク質のカルボキシル基(R-COOH)やスルフヒドリル基(R−SH)などと結合させます。 - 還元して銀を発生させる。
銀イオン[Ag(NH3)2]+をアルデヒドやチオ硫酸ナトリウムで還元することで、金属銀を発生させ、タンパク質のバンドを可視化しています。
以下の図は、アルデヒド(R-CHO)と硝酸銀[Ag(NH3)2]から銀が発生する反応を示しています。
銀染色のプロトコル-質量分析対応法-
グルタルアルデヒド(Glutaraldehyde)およびホルムアルデヒド(Formaldehyde)を使用しない銀染色法を紹介します。グルタルアルデヒドとホルムアルデヒドは、タンパク質のリジン残基などを架橋する性質があり、消化酵素の切断効率の低下に繋がります。
そのため、銀染色後にバンドを切り出し、消化酵素処理をする場合は、以下で紹介しているようなグルタルアルデヒドおよびホルムアルデヒドを使用しない銀染色法を採用します。もちろん、単にバンドを可視化する通常の銀染色法としても使用できます。
銀染色に必要な試薬
- 100% エタノール(Ethanol, C2H5OH, CAS No. 64-17-5)
市販品例:富士フイルム和光純薬#057-00456, 関東化学#14034-00 - 酢酸(Acetic Acid, CAS No. 64-19-7, CH3COOH)
市販品例:富士フイルム和光純薬#014-00266, 関東化学# 01021-01, ナカライテスク#00211-95, 東京化成#A2035 - チオ硫酸ナトリウム・5水和物(Sodium thiosulphate pentahydrate, Na2S2O3・5H2O, CAS No. 10102-17-7)
市販品例:富士フイルム和光純薬#193-03582, 東京化成#O0522, ナカライテスク#32005-15 - 硝酸銀(Silver nitrate, AgNO3, cAS No. 7761-88-8)
市販品例:富士フイルム和光純薬#194-00832, ナカライテスク#31018-72 - 炭酸カリウム(Potassium carbonate, K2CO3, CAS No.584-08-7)
市販品例:富士フイルム和光純薬#168-03492, 東京化成#P1748 - 37% ホルムアルデヒド溶液(Formaldehyde, HCHO, CAS No. 50-00-0)
市販品例:富士フイルム和光純薬#064-00406, 関東化学#16061-00 - トリス(Tris, CAS No. 77-86-1, NH2C(CH2OH)3)
市販品例:富士フイルム和光純薬#203-06272, 関東化学# 40326-00, MERCK#T1503-25G - タッパーもしくはトレイ
- シェイカー

銀染色試薬の作製・組成(1L, ミニゲル約20枚分)
- 固定液(1L); Fixation solution
300mLのエタノール、100mLの酢酸、600mLの脱イオン水を混合します。
室温で保管します。 - 20v/v% エタノール(1L)
200mLのエタノールと800mLの脱イオン水を混合します。
室温で保管します。 - 増感液(1L); Sensitization solution
300mgのチオ硫酸ナトリウム・5水和物を1Lの脱イオン水で溶解します。
用事調製を推奨します。 - 銀染色液(1L); Silver solution
2gの硝酸銀を1Lの脱イオン水で溶解します。
用事調製を推奨します。 - 現像液(1L) ; Development solution
30gの炭酸カリウムと15mgのチオ硫酸ナトリウム・5水和物を1Lの脱イオン水で溶解します。そこへ700μLの37%ホルムアルデヒド溶液を添加し、攪拌します。
用事調製を推奨します。 - 反応停止液(1L); Stop solution
50gのトリスを25mLの酢酸と975mLの脱イオン水で溶解します。
室温保管で3か月は保管できます。
銀染色のプロトコル(ミニゲル1枚分)
すべて50mLを使用していますが、小さいタッパーを使用する場合は、もっと少ない液量でも問題ありません。
- タンパク質の固定; Fixation
タッパーに50mLの固定液を注ぎ、SDS-PAGE後のゲルを浸します。タッパーをシェイカーに乗せ、穏やかに1時間以上振とうします。オーバーナイトでも構いません。 - 洗浄; Washing
タッパーの固定液を捨て、50mLの20v/v% エタノールをタッパーへ注ぎます。シェイカーで穏やかに15分間振とうします。 - 増感; Sensitization
タッパーの20v/v% エタノールを捨て、50mLの増感液をタッパーへ注ぎます。シェイカーで穏やかに90秒間振とうします。厳密に時間を測ります。 - 洗浄; Washing
タッパーの増感液を捨て、50mLの脱イオン水を注ぎます。シェイカーで20秒間振とうします。厳密に時間を測ります。 - 染色; Staining
タッパーの脱イオン水を捨て、50mLの銀染色液を注ぎます。シェイカーで30分間振とうします。 - 洗浄; Washing
タッパーの銀染色液を捨て、50mLの脱イオン水を注ぎます。シェイカーで20秒間振とうします。厳密に時間を測ります。
使用済みの銀染色液から爆発性の銀アミドが生じる恐れがあります。使用後は塩化ナトリウムか塩酸を加え、白濁(塩化銀)させてから廃棄します。 - 現像; Development
タッパーの脱イオン水を捨て、50mLの現像液を注ぎます。シェイカーで穏やかに振とうします。タンパク質のバンドが見えるまで振とうします。目安は2-5分間です。 - 反応停止; Stop
50mLの反応停止液をタッパーへ添加します。
銀染色の操作動画
上記プロトコルとまったく同じではありませんが、具体的な操作方法がわかる動画です。
銀染色のトラブルシューティング
銀染色はちょっとした操作の差や温度の差でうまくいかないことがあります。原因を考えて再トライしてみてください。

- 染色されない
・タンパク質の量が少ない。少なくとも単一タンパク質で数ナノグラムは必要です。
・増感処理の時間が短い。この処理は数十秒の差で成否が分かれます。
・増感後の洗浄処理の時間が長い。
・室温が低い。20℃以上の部屋で行います。
・試薬の温度が低い。室温に戻してから使用します。 - バックグラウンドが高い
・試薬や水に不純物が含まれている。不純物の少ない試薬と精製度の高い水を使用してください。
・固定液処理が不十分。ゲル中にSDS(ドデシル硫酸ナトリウム)とグリシンが大量に残存していると、これらへ銀イオンが結合するため、ゲル全体が染まります。
・染色時間時間が短い。
こちらの記事もチェック!
各社プレキャストゲル価格比較一覧|最安値は?
CBB染色の原理とプロトコル(方法)・組成【SDS-PAGE】
SDS-PAGEの仕組み:原理と成分の役割(電荷、分子量)
参考文献
- Addgene, AAV Purification by Iodixanol Gradient Ultracentrifugation.
- CONDUCTSCIENCE, Silver Staining Protocol.
- Turku Bioscience(2019)Mass Spectrometry Compatible Silver Staining.
- 化学のグルメ, 銀鏡反応









コメントを残す