SARS-CoV-2を原因とする新型コロナウイルス感染症(COVID-19)の流行が続く中、冬が近づくにつれて季節性インフルエンザも流行する恐れがあります。すでに、COVID-19 とインフルエンザの混合感染も報告されています。
日本感染症学会は、季節性インフルエンザの流行に備え、⽇本感染症学会提⾔として「今冬のインフルエンザと COVID-19 に備えて」を公開しました。COVID-19あるいは季節性インフルエンザの相違点、またそれらが疑われる場合の検査および治療方針が述べられています。
以下は、⽇本感染症学会提⾔「今冬のインフルエンザと COVID-19 に備えて」の全文です。
Ⅰはじめに
2019 年 12 ⽉に中国湖北省武漢にて発⽣した新型コロナウイルス感染症(COVID-19)は、急速に世界中に広がり、2020 年 7 ⽉下旬の段階で、全世界で感染者約 1,600 万⼈、死亡者約 65 万⼈と報告されています 1)。
わが国においても、2020 年 1 ⽉ 15 ⽇に最初の患者が報告されて以降、患者数は増加し続け、7 ⽉ 28 ⽇の時点で感染者数累計 31,333 ⼈、死亡者 1,000 ⼈となっています 2)。患者数は 5 ⽉上旬をピークに⼀旦減少し、全国での緊急事態宣⾔が解除されましたが、その後も再増加がみられ、第 2 波の到来が疑われています。⼀⽅、従来のコロナウイルスの伝播モデルから SARS-CoV-2 の流⾏を推測した研究によると、次の冬季に COVID-19 の⼤きな流⾏が起こることが予測されています 3)。特に、インフルエンザの流⾏期と重なることにより、重⼤な事態になることが危惧されます。また、中国からブタ由来の新型インフルエンザの発⽣も報告されており 4)、今後の動向に留意する必要があります。
これらのことを勘案して、⽇本感染症学会では、新たにインフルエンザ−COVID-19 アドホック委員会を組織し、今冬に向けて提⾔を⾏うこととしました。この提⾔は、専⾨的な診療についてではなく、⼀般のクリニックや病院での外来診療を対象としたものとします。また、⼩児については、軽症者や無症状者が多いこと、検査が⾏いにくい場合があること、インフルエンザ以外にも多くの発熱性疾患があること等により、別項を設けて解説したいと思います。COVID-19 の状況は流動的であり、今後多くの新情報や知⾒が出てくることが予想されます。必要に応じて改訂を⾏っていきたいと思います。
Ⅱ インフルエンザと COVID-19
2019-2020 年シーズンのインフルエンザについては、例年に⽐して、2020 年に⼊ってから患者数が⼤きく減少していることが、わが国から報告されています 5)。結局、A(H1N1) pdm09 による700 万⼈規模の⼩流⾏に終わりました。これは、COVID-19 対策としての⾶沫感染対策、および⼿指衛⽣等の予防策が、インフルエンザについても有効であったことを⽰唆していますが、インフルエンザ患者減少は世界的に⾒られ、SARS-CoV-2 の出現が、インフルエンザ流⾏に何らかの原因で、⼲渉したとの説も考えられています 6)。同時流⾏が起こるか⼲渉がみられるかは、今年夏季の南半球の流⾏状況に注⽬する必要があります。
⼀⽅、COVID-19 とインフルエンザとの合併も報告されるようになりました。これらの報告によると、インフルエンザとの混合感染は、COVID-19 による⼊院患者の 4.3-49.5%に認められています 7-9)。インフルエンザ合併例では、⿐閉や咽頭痛が多く認められる傾向にありました。インフルエンザ⾮合併患者に⽐して、重症度や検査所⾒に差異はみられなかったとある⼀⽅で、B 型インフルエンザとの合併症例は重症化したという報告もあります 10)。
Meta-analysis によると、SARS-CoV-2 では、細菌感染合併は 7%、RS ウイルスやインフルエンザなどウイルス感染との合併は3%と報告されています 11)。2COVID-19 とインフルエンザとの鑑別を⾏う試みがなされています。Luo らは、COVID-19 肺炎とインフルエンザ肺炎とを、それぞれ 1,000 例以上集積した上で⽐較し、⾎液検査所⾒の多変量解析により、両者の鑑別が可能であるとしています 12)。また、CT 所⾒を⽤いる解析も報告されています 13, 14)。
インフルエンザと COVID-19 の臨床上の相違について、下記の表 1 のようにまとめます。COVID-19 では、無症状感染者(asymptomatic infection)が⾼頻度に存在し、⼩児で 13%15)、武漢から帰国した⽇本⼈では 30%16)と報告されています。無症状であっても、気道のウイルス量は多く、発症直前に最⼤量となり、感染性が強くなります(pre-symptomatic infection)17-19)。そのため、症状から感染者を診断、隔離することは困難と考えられます。
| 項目 | インフルエンザ | COVID-19 |
|---|---|---|
| 症状の有無 | ワクチン接種の有無などにより程度の差があるものの、しばしば⾼熱を呈する | 発熱に加えて、味覚障害・嗅覚障害を伴うことがある |
| 潜伏期間 | 1-2 ⽇ | 1〜14 ⽇(平均 5.6 ⽇) |
| 無症状感染 | 10% 無症状患者では、ウイルス量は少ない | 数%〜60% 無症状患者でも、ウイルス量は多く、感染⼒が強い |
| ウイルス排出期間 | 5-10 ⽇(多くは 5-6 ⽇) | 遺伝⼦は⻑期間検出するものの、 感染⼒があるウイルス排出期間は 10 ⽇以内 |
| ウイルス排出のピーク | 発病後 2,3 ⽇後 | 発病 1 ⽇前 |
| 重症度 | 多くは軽症~中等症 | 重症になりうる |
| 致死率 | 0.1%以下 | 3-4% |
| ワクチン | 使⽤可能だが季節毎に有効性は異なる | 開発中であるものの、現時点では有効なワクチンは存在しない |
| 治療 | オセルタミビル、ザナミビル、ペラミビル、ラニ ナミビル、バロキサビル マルボキシル | 軽症例については、確⽴された治療薬はなく、 多くの薬剤が臨床治験中 |
| ARDS の合併 | 少ない | しばしばみられる |
⼀⽅、インフルエンザの無症状感染の割合は、家族内感染を PCR でフォローした報告では、11%と報告されています 20)。発症 1 ⽇前から気道にウイルスが存在しますが、ウイルス量は少なく感染⼒は弱いです。発症 2⽇⽬になると、気道のウイルス量は増加し迅速診断も陽性化します。
したがって、インフルエンザは原則として、発熱を指標に診断、患者隔離が可能です。上記のような検討はあるものの、外来診療の場において、確定患者と明らかな接触があった場合や、特徴的な症状(インフルエンザにおける突然の⾼熱発症、COVID-19 における味覚障害や嗅覚障害など)がない場合、臨床症状のみで両者を鑑別することは困難です。
COVID-19 については、地域により流⾏状況に⼤きな差異があります。患者の発⽣がみられ、COVID-19 患者に遭遇する蓋然性の⾼い地域では、冬季に発熱患者や呼吸器症状を呈する患者を診る場合は、インフルエンザと COVID-19 の両⽅の可能性を考える必要があります。COVID-19の流⾏レベルを便宜上、表 2 のように定義しますので、⽬安としてください。都道府県で流⾏レベルのアセスメントがされているような場合には、それを参考としてください。
| Level | 当該医療機関がカバーする医療圏 | 隣接する医療圏 | 都道府県全体 |
|---|---|---|---|
| 1 | 14 ⽇以内のCOVID-19 発⽣例なし。 | 14 ⽇以内のCOVID-19 発⽣例なし。 | 14 ⽇以内のCOVID-19 発⽣例なし。 |
| 2 | 14 ⽇以内のCOVID-19 発⽣例なし。 | 14 ⽇以内に感染経路が特定できているCOVID-19 発⽣例がある。 (クラスタ−事例含む) | ・14 ⽇以内に感染経路が特定できているCOVID-19 発⽣例がある。 ・14 ⽇以内に限られた地域にのみ、感染経路が不明なクラスタ−が発⽣している。 |
| 3 | 14 ⽇以内に感染経路が特定できているCOVID-19 発⽣例がある。 | 14 ⽇以内に感染経路が不明のCOVID-19 発⽣例がある。(クラスタ−事例含む) | 14 ⽇以内に(地理的に交流の程度が 低い)複数の地域で、それぞれ感染経路不明のクラスタ−が発⽣している。 |
| 4 | 14 ⽇以内に感染経路が不明のCOVID-19 発⽣例がある。(クラスタ−事例含む) | 14 ⽇以内に感染経路が不明のCOVID-19 クラスタ−が複数発⽣している。 | 14 ⽇以内に、すべての地域において、感染経路不明のクラスタ−が発⽣している。 |
*表 2、表 3 については、レベル分類と対応についての実例として挙げた。実際には、都道府県でのリスクアセスメントも参考にすること。
*医療圏:各地域で定義する。各医療圏内でさらに医療圏を細分化するかどうかは各医療機関の判断に委ねる。
*「当該医療機関がカバーする医療圏」、「隣接する医療圏」、「都道府県内全体」のいずれかの COVID-19 流⾏状況が当てはまるとき、当該レベル
にあると判断する。
Ⅲ 検査について
上述したように、COVID-19 患者の発⽣がみられる地域での流⾏期にはインフルエンザとCOVID-19 の両⽅の患者に遭遇する可能性があります。
臨床診断のみでインフルエンザとして治療を⾏う場合、COVID-19 を⾒逃してしまうおそれがあります。そのため、原則として、COVID19 の流⾏がみられる場合には、インフルエンザが強く疑われる場合を除いて、可及的に両⽅の検査を⾏うことを推奨します。検体はなるべく同時に採取します。
各流⾏レベルにおける、インフルエンザ様症状を呈する患者に対する SARS-CoV-2 検査の適応指針を表 3 に⽰します。ただ、SARS-CoV-2 の検査の供給は限られていますので、流⾏状況により、先にインフルエンザの検査を⾏い、陽性であればインフルエンザの治療を⾏って経過を⾒ることも考えられます。
| Level | SARS-CoV-2 検査(迅速診断キットあるいは PCR、LAMP)の適応 |
|---|---|
| 1 | ・原則不要。 ・14 ⽇以内に、陽性例の報告のあった都道府県への移動歴(居住歴)がある、または移動歴(居住歴)のある者との濃厚接触がある場合には考慮する。 |
| 2 | ・14 ⽇以内に、陽性例の報告のあった都道府県への移動歴(居住歴)がある、または移動歴(居住歴)のある者との濃厚接触がある場合には考慮する。 ・14 ⽇以内に COVID-19 のクラスタ−発⽣があった都道府県内地域への移動歴(居住歴)、または移動歴(居住歴)のある者との濃厚接触がある場合には考慮する。 |
| 3 | ・14 ⽇以内に、陽性例の報告のあった都道府県への移動歴(居住歴)がある、または移動歴(居住歴)のある者との濃厚接触歴がある場合には考慮する。 ・14 ⽇以内に COVID-19 のクラスタ−発⽣があった都道府県内地域への移動歴(居住歴)、または移動歴(居住歴)のある者との濃厚接触がある場合には考慮する。 ・14 ⽇以内に濃厚接触者の定義に当てはまる場合には⾏う。 |
| 4 | ・発熱がある場合には全例⾏うことが望ましい。 |
*表 2、表 3 については、レベル分類と対応についての実例として挙げた。実際には、都道府県でのリスクアセスメントも参考にすること。
*Level については、表1を参照。各レベルにおいて、受診患者(有症状者)が上記に該当する場合に、SARS-CoV-2 の検査を検討する。
*原因不明の肺炎、嗅覚味覚異常、年⻑⼩児の川崎病様症状(pediatric inflammatory multisystemsyndrome temporally associated with SARS-CoV-2 infection)、濃厚接触者は、いずれのレベルでも適応となる可能性が⾼い。
*医療関係者、⾼齢者、ハイリスク者では、検査を積極的に検討する。
*SARS-CoV-2 陽性であっても、他の感染症との重感染が否定はできないことにも留意する。
個⼈防護具(personal protective equipment: PPE)の供給が⼗分でなく、⾃施設で検体採取が困難な場合は、地域の検体採取センターに検査を依頼することも可能です。⾃施設で検体をとる場合には、感染防御に⼗分留意する必要があります。交差感染を防⽌するために、時間的、空間6的に隔離して検査を⾏うことが薦められ、可能であれば屋外や⾃動⾞内での検体採取も考えられます。診察室で検体を採取した場合は、次の患者が⼊室する前に⼗分な換気を⾏うことが必要です。
医療従事者を含めた伝播リスクならびにその低減に関する検証では、マスクおよび⽬の保護具が有⽤であると報告されています 21)。国⽴感染症研究所、および国⽴国際医療研究センター国際感染症センターの新しいガイドラインなどでは、呼吸器症状を呈する外来患者に対する個⼈防護具使⽤の推奨は表 4 のようになっています 22)。⿐咽頭ぬぐい液の採取時には、必ずしも N95 マスクではなく、サージカルマスク着⽤でも可となりました。診察時には、患者にはサージカルマスクの着⽤が薦められます。また、欧州 CDC の technical report でも、N95 マスクの不⾜時には、サージカルマスクで可としています 23)。できるだけ、換気の良い部屋(空間)で検体採取を⾏ってください。N95 マスクを使⽤する場合は、ユーザ−シールチェックやフィットテストを⾏い、適正に使⽤することが必要です。
| サージカルマスク | N95 マスク | ⼿袋 | ガウン | アイガード | 帽⼦ | |
|---|---|---|---|---|---|---|
| 患者 | 〇 | |||||
| 医療従事者(診察) | 〇 | |||||
| 医療従事者(検体採取) | 〇 | 〇*1 | △*2 | 〇*1 | △*3 | |
| エアロゾルを⽣じる処置*4 | 〇 | 〇 | 〇 | 〇 | 〇 |
*1 上気道検体採取を実施する場合(唾液検体を回収する際にはサージカルマスクと⼿袋)
*2 患者に直接接触するときや上気道検体を採取するときに着⽤
*3頭髪に触れるリスクがある場合
*4気管挿管・抜管、NPPV 装着、気管切開術、⼼肺蘇⽣、⽤⼿換気、気管⽀鏡検査、ネブライザー療法、誘発喀痰など(⿐咽頭ぬぐい液の採取は該当しない)
インフルエンザについては、以前より抗原迅速診断キットが普及していますが、SARS-CoV-2についても抗原検出⽤キットが開発されています。この抗原迅速診断キットは、PCR 法に⽐して感度が低いとされています 24, 25)が、発症第 1 週に検査を⾏えば、感度・特異度とも⾼かったとする報告もあります 26)。ただ、インフルエンザの抗原迅速診断キットと異なり、SARS-CoV-2 抗原迅速診断キットの供給量は限られています。
国内ではエスプライン SARS-CoV-2(富⼠レビオ)が認可されていますが、COVID-19 感染症を疑う症状があると判断される場合に使⽤が許可されています。PCR 法に⽐して検出に⼀定以上のウイルス量が必要であり、無症状者では検査前確率が低いと想定されることより、無症状者に対してやスクリーニング⽬的での使⽤は推奨されていません 27)。陽性の場合は、確定診断とすることが出来ます。陰性の場合、発症後 2-9 ⽇⽬以内であれば、追加の PCR 検査を必須とはせず、7発症⽇または 10 ⽇⽬以降であれば、確定診断のために医師の判断で PCR 検査等を⾏う必要があるとなっています 28)が、陰性であっても SARS-CoV-2 感染を否定するものではなく、臨床症状も含め総合的に判断する必要があります 27)。
保険上は 1 回のみの算定(600 点)としますが、陰性であったものの新型コロナウイルス感染症以外の診断がつかない場合には、さらにもう 1 回の算定が可能です。なお新型コロナウイルス(SARS-CoV-2)抗原の迅速診断キット「エスプライン® SARS-CoV-2」で⽤いる検体処理液が、インフルエンザウイルス抗原の迅速診断キット「エスプライン インフルエンザ A&B-N」においても使⽤できることが確認されました 29)。
なお、抗原迅速診断キットを使⽤した際、結果が出るまでには 30 分かかります。その間、感染伝播が起こらないように患者の滞在場所を考慮することが必要です。
⿐かみ液の使⽤について
⿐咽頭ぬぐい液を採取する場合は、⾶沫発⽣の可能性があります。代替法として、⿐かみ液の使⽤が考えられます。⿐かみ液は、すでにインフルエンザ診断に使⽤されており、対応できる抗原迅速診断キットも複数あります。
インフルエンザについての国内からの報告では、検出率は⿐咽頭ぬぐい液に⽐してやや低いものの、A 型で 86%、B 型で 77%と良好でした 30)。⿐かみ液使⽤の⼿順については、検査会社のホームページ 31)をご参照ください。SARS-CoV-2 検出キットについて、⿐かみ液のエビデンスはまだなく、現時点では推奨しません。
唾液の使⽤について
COVID-19 発症から9⽇⽬程度は、唾液中のウイルス検出率も⽐較的⾼いことが報告されており、唾液を⽤いた診断の有⽤性が⽰唆されています 32, 33)。
2020 年6⽉ 19 ⽇に、SARS-CoV-2 の抗原を測定する全⾃動検査機器⽤試薬(ルミパルス SARSCoV-2 富⼠レビオ)が承認され、従来の⿐咽頭ぬぐい液に加え、唾液も検体として利⽤することが可能となりました。全⾃動化学発光酵素免疫測定システム(ルミパルス G1200、G600Ⅱ)で使⽤するための試薬です。唾液を検体とする抗原検査の対象者は、当初、発熱などの症状発症から 9 ⽇以内の患者とされていましたが、無症状者にも適応が拡がりました。唾液検体が使⽤できるのは、PCR 検査、LAMP 検査、抗原定量検査であり、抗原迅速診断キットには使⽤できません。唾液検体の採取時は、滅菌容器に 1〜2mL 程度の唾液を 5〜10 分かけて患者に⾃⼰採取させることになっています。
クリニックで唾液を採取される場合には、測定機器のある施設や検査センターへ搬送することが必要になります。採取・搬送の⽅法や注意点については、国⽴感染症研究所の「検体採取・輸送マニュアル」をご参照ください 34)。集配ネットワークができている地域では、それを利⽤していただければと思います。
⿐前庭検体の取り扱いについて
⿐前庭ぬぐい液が、インフルエンザや SARS-CoV-2 の検査に有⽤であることが報告されており35, 36)、今後使⽤できる可能性があります。医療従事者への曝露を軽減することができると考えられます。
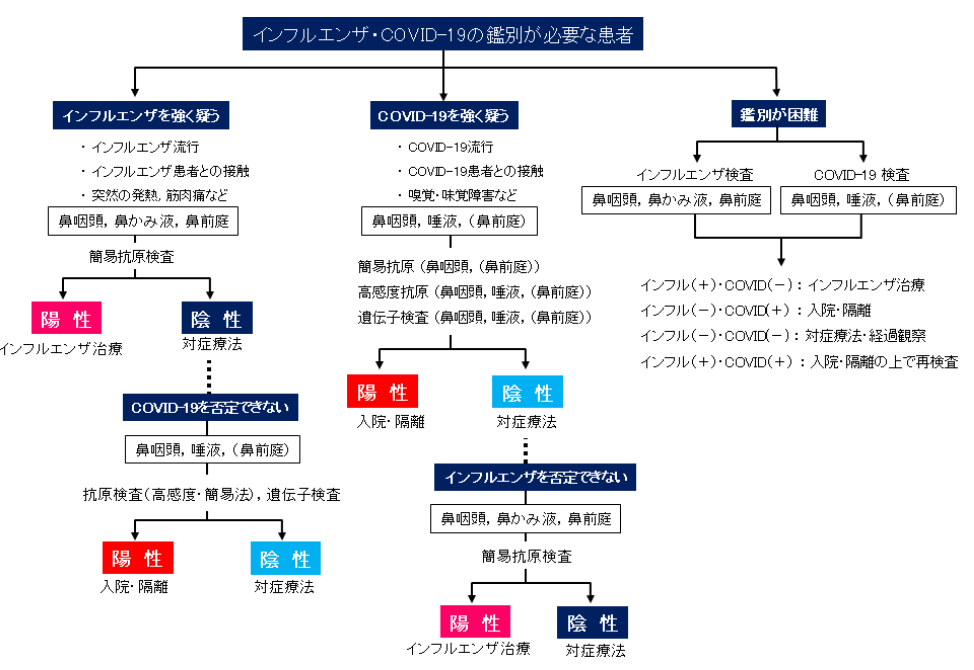
実臨床では、インフルエンザと SARS-CoV-2 の両⽅を同時に検査する場合のみならず、どちらかを強く疑って検査を⾏うこともあると思われます。これら場合における診療検査の進め⽅の考え⽅のフローチャートを図に⽰します。
Ⅳ 治療について
今冬、インフルエンザと COVID-19 が同時に流⾏することが懸念されており、実際にはインフルエンザは COVID-19 よりも多くの患者数が予想されます。また、現在のところ、COVID-19 を⼀般外来において抗ウイルス薬等で治療することは想定されておりませんので、今冬の発熱患者診療の治療の主体はインフルエンザとなります。
2018 年にバロキサビル マルボキシル(ゾフルーザ、以下、バロキサビル)が市販されたこともあり、⽇本感染症学会では、抗インフルエンザ薬の適正な使⽤を⽬的として提⾔を⾏ってきました。2019 年 10 ⽉の「〜抗インフルエンザ薬の使⽤について〜」では、「バロキサビルについては,まだ⼗分なエビデンスに乏しく,今後の基礎および臨床のデータの蓄積と解析により,その使⽤⽅針に変更の可能性があります。」としました37)。本項を参考にして裁量していただければと思います。
今冬においても、インフルエンザは早期診断に基づく、早期治療を⾏うことを推奨します。現在のところ、本学会の提⾔の内容について⼤きく変更する必要はないものの、2019/2020 シーズンではバロキサビルに対する PA 変異株の検出は少ないこと、成⼈のハイリスク患者を含めてバロキサビルの知⾒が増えつつあります。今後も薬剤感受性の動向に留意し、適切な診断と治療を⾏っていただきたいと考えます。
薬剤感受性サーベイランスについて
2017/2018 シーズン(バロキサビル上市前)におけるグローバルサーベイランスでは、NA 変異は 0.8%、PA 変異は 0.08%と報告されています 38)。わが国における 2019/2020 シーズンは例年より⼩さい流⾏であったものの、H1N1 でオセルタミビル、ペラミビルに対する変異株が 1.6%、バロキサビルに対する変異株が 0.13%にみられました。ザナミビル、ラニナビルの変異株は認められず、H3N2、B 型インフルエンザは何れの薬剤の変異株も検出されませんでした 39)。
バロキサビルと変異ウイルスについて
現在のところ、バロキサビル変異株に関する臨床的意義は確定していません。1〜11 歳未満の⼩児では安全に投与されたものの、PA 変異株では変異のない場合と⽐較して罹病期間の延⻑がみられ、PA 変異株の患者群では抗体価が低かったと報告されています 40)。また、11 歳未満では変異株と⾮変異株では解熱期間は同様であるものの、変異株ではウイルス排出期間の延⻑がみられました 41)。
⼀⽅、H3N2 インフルエンザに対するバロキサビル投与後の変異群でも解熱期間は同様とする報告をはじめ 42)、10 歳未満でも同等 43)、成⼈のハイリスク患者を含め PA 変異株と⾮変異株では変わりない 44)とする報告もあります。したがって、他の抗インフルエンザ薬と同様に、経過を丁寧に評価する必要があります。
抗インフルエンザ薬について
ノイラミニダーゼ阻害薬は有熱期間の短縮や⼆次性細菌性感染症や合併症の減少につながることが知られていることに加えて、meta-analysis において⼊院期間の短縮に繋がることが報告されました 45)。12 歳以上のハイリスク患者(糖尿病、喘息または慢性肺疾患、⼼疾患などの基礎疾患を有する患者、65 歳以上の⾼齢者など)を対象とした無作為⽐較試験では、バロキサビル投与群は罹病期間の短縮ならびに合併症の抑制がみられ、B 型インフルエンザではバロキサビル投与群はオセルタミビル群より臨床症状の改善がみられました 44)。
インフルエンザ検査診断だけでなく、インフルエンザ様症状による検討においてもオセルタミビル投与群は、健常⼈ならびにハイリスク患者でより改善が認められました 46)。しかしながら、抗インフルエンザ薬は対象ならびに使⽤状況によっては薬剤耐性の懸念があります。1〜5 歳の⼩児ではより NA 変異がみられるとともに、ウイルス排出期間の延⻑が報告されています 47)。また、院内感染対策としてノイラミニダーゼ阻害薬を予防内服中に、NA 変異株による集団感染が発⽣しバロキサビル投与によって収束したという報告があります 48)。COVID-19 とインフルエンザの同時流⾏においては、臨床診断で投薬加療することも検討されるものの、適切な検査を含めた丁寧な診断と治療薬の選択が重要です。
近年ではパンデミックを含め数理モデルを⽤いた感染症の疫学研究が⾏われています。抗インフルエンザ薬(バロキサビル)による早期治療は⼆次感染ならびに関連の死亡数を減らすことが⽰唆されており 49)、このような研究の発展も期待されます。
また、今冬も発⽣が懸念される COVID-19 では、エアロゾル発⽣⼿技(気管内挿管、気管⽀鏡検査、陽圧換気、ネブライザー等)による感染伝播リスクが指摘されていることから、ラニナミビルをネブライザーとして⽤いる際には、その適応や感染対策に⼗分留意する必要があります。
なお、抗インフルエンザ薬としては,ファビピラビル(アビガン○R)が 2014 年 3 ⽉に認可されており、COVID-19 の治療薬候補ともなっていますが、適応が「新型⼜は再興型インフルエンザ感染症(ただし,他の抗インフルエンザウイルス薬が無効⼜は効果不⼗分なものに限る)」とされること、現在のところ本項の対象である通常の外来診療では使⽤を想定しないため取り上げていません。また、国内の COVID-19 の特定臨床研究において、ファビピラビルは、通常投与群(1⽇⽬から内服)と、遅延投与群(6 ⽇⽬から内服)の間で有意な差は認められませんでした 50)。
Ⅴ ワクチンについて
今冬は、COVID-19 とインフルエンザの同時流⾏を最⼤限に警戒すべきであり、医療関係者、⾼齢者、ハイリスク群の患者も含め、インフルエンザワクチン接種が強く推奨されます。SARSCoV-2 のワクチンについては、現在開発中ですが、臨床に導⼊されるようになれば、医療従事者、ハイリスク者を中⼼に、接種対象者を規定することが必要です。
文献
1) Johns Hopkins University Coronavirus Research Center. COVID-19 dashboard.
https://coronavirus.jhu.edu/map.html
2) 厚⽣労働省. 新型コロナウイルス感染症国内の発⽣状況. https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000164708_00001.html#kokunaihassei
3) Kissler SM, Tedijanto C, Goldstein E, et al. Projecting the transmission dynamics of SARS-CoV-2 through the postpandemic period. Science 2020; 368: 860-868.
https://science.sciencemag.org/content/368/6493/860
4) Sun H, Xiao Y, Liu J, et al. Prevalent Eurasian avian-like H1N1 swine influenza virus with 2009 pandemic viral genes facilitating human infection. Proc Natl Acad Sci USA 2020 June 29, doi.org/10.1073/pnas.1921186117
https://pubmed.ncbi.nlm.nih.gov/32601207/
5) Sakamoto H, Ishikane M, Ueda P. Seasonal influenza activity during the SARS-CoV-2 outbreak in Japan. JAMA 2020; 323: 1969-1971.
https://pubmed.ncbi.nlm.nih.gov/32275293/
6) Lina B. Clinical Manifestations of COVID-19, influenza and RSV: full webinar
https://vimeo.com/432055343
7) Cuadrado-Payán E, Montagud-Marrahi E, Torres-Elorza M, et al. SARS-CoV-2 and influenza virus co-infection. Lancet 2020 May 16; 395(10236): e84. doi: 10.1016/S0140-6736(20)31052-7.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31052-7/fulltext
8) Ding Q, Lu P, Fan U, et al. The clinical characteristics of pneumonia patients coinfected with 2019 novel coronavirus and influenza virus in Wuhan, China. J Med Virol 2020 Mar
20;10.1002/jmv.25781. doi: 10.1002/jmv.25781.
https://onlinelibrary.wiley.com/doi/10.1002/jmv.25781
9) Ma S, Lai X, Chen Z, et al. Clinical characteristics of critically ill patients co-infected with SARSCoV-2 and the influenza virus in Wuhan, China. Int J Infect Dis 2020 May 26; 96: 683-687. doi:10.1016/j.ijid.2020.05.068.
https://www.ijidonline.com/article/S1201-9712(20)30375-1/fulltext
10) Yue H, Zhang M, Xing L, et al. The epidemiology and clinical characteristics of co-infection of SARS-CoV-2 and influenza viruses in patients during COVID-19 outbreak. J Med Virol 2020 Jun 12;10.1002/jmv.26163. doi: 10.1002/jmv.26163.
https://onlinelibrary.wiley.com/doi/10.1002/jmv.26163
11) Lansbury L, Lim B, Baskaran V, et al. Co-infections in people with COVID-19: a systematic review and meta-analysis. J Infect 2020 May 27:S0163-4453(20)30323-6. doi: 10.1016/j.jinf.2020.05.046.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7255350/
12) Luo Y, Yuan X, Xue Y, et al. Using a diagnostic model based on routine laboratory tests to distinguish patients infected with SARS-CoV-2 from those infected with influenza virus. Int J Infect Dis 2020 Jun; 95: 436-440. doi: 10.1016/j.ijid.2020.04.078.
https://pubmed.ncbi.nlm.nih.gov/32371192/
13) Liu M, Zeng W, Wen Y, et al. COVID-19 pneumonia: CT findings of 122 patients and differentiation from influenza pneumonia. Eur Radiol 2020; 12; 1-7. doi: 10.1007/s00330-020-06928-0.
14) Wang H, Wei R, Rao G, et al. Characteristic CT findings distinguishing 2019 novel coronavirus disease (COVID-19) from influenza pneumonia. Eur Radiol 2020 Apr 22; 1-8.
15) Lu X, Zhang L, Du H, et al. SARS-CoV-2 infection in children. N Engl J Med 2020; 382:1663-1665.
16) Nishiura H, Kobayashi T, Miyama T, et al. Estimation of the asymptomatic ratio of novel coronavirus infections (COVID-19). Int J Infect Dis 2020; 94: 154-155.
17) Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020; 581: 465-469.
18) He X, Lau EHY, Wu P, et al. Temporal dynamics in viral shedding and transmissibility of COVID19. Nat Med 2020; 26: 672-675.
19) Gandhi M, Yokoe DS, Havlir DV. Asymptomatic transmission, the Achilles’ heel of current strategies to control covid-19. N Engl J Med 2020; 382: 2158-2160.
20) Ip DKM, Lau LLH, Chan KH, et al. The Dynamic relationship between clinical symptomatology and viral shedding in naturally acquired seasonal and pandemic influenza virus infections. ClinInfect Dis 2016; 62: 431-437.
21) Chu DK, Akl EA, Duda S, et al. Physical distancing, face masks, and eye protection to prevent person-to-person transmission of SARS-CoV-2 and COVID-19: a systematic review and metaanalysis. Lancet 2020; 395: 1973-1987.
22) 国⽴感染症研究所、国⽴国際医療研究センター 国際感染症センター. 新型コロナウイルス感染症に対する感染管理. 2020 年 6 ⽉ 2 ⽇
https://www.niid.go.jp/niid/images/epi/corona/2019nCoV-01-200602.pdf
23) European Center for Disease Prevention and Control. Infection prevention and control and preparedness for COVID-19 in healthcare settings. Fourth update 3 July 2020.
https://www.ecdc.europa.eu/sites/default/files/documents/Infection-prevention-and-control-inhealthcare-settings-COVID-19_4th_update.pdf
24) Scohy A, Anantharajah A, Bodéus M. Low performance of rapid antigen detection test as frontline testing for COVID-19 diagnosis. J Clin Virol 2020 May 21; 129: 104455. doi:10.1016/j.jcv.2020.104455.
25) Mak GC, Cheng PK, Lau SS. Evaluation of rapid antigen test for detection of SARS-CoV-2 virus. J Clin Virol 2020 Jun 8; 129: 104500. doi: 10.1016/j.jcv.2020.104500.
26) Porte L, Legarraga P, Vollrath V, et al. Evaluation of novel antigen-based rapid detection test for the diagnosis of SARS-CoV-2 in respiratory samples. Int J Infect Dis 2020 Jun 1; S1201-9712(20)30405-7. doi:10.1016/j.ijid.2020.05.098.
27) 富⼠レビオ株式会社. エスプライン SARS-CoV-2 添付⽂書.
https://www.info.pmda.go.jp/tgo/pack/30200EZX00026000_A_01_04/30200EZX00026000_A_01_04?view=body
28) 厚⽣労働省新型コロナウイルス感染症対策本部. SARS-CoV-2 抗原検出⽤キットの活⽤に関するガイドライン. 2020 年 6 ⽉ 16 ⽇ https://www.mhlw.go.jp/content/000640554.pdf
29) H.U.グループホールディングス株式会社.新型コロナウイルスおよびインフルエンザウイルスの同⼀検体を⽤いた迅速抗原検査について.2020 年 7 ⽉ 27 ⽇ https://ssl4.eirparts.net/doc/4544/tdnet/1863060/00.pdf
30) 三⽥村敬⼦、⼭崎雅彦、市川正孝、他. 検査材料と診断キット:⿐かみ液の検討. インフルエンザ 2008; 9: 35-41.
31) SB バイオサイエンス. QuickVue ラピッド SP influ 検体採取法
https://www.sbbio.co.jp/seihinjouhou/b03/b03_kentai.html
32) To KK, Tsang OT, Chik-Yan Yip C, et al. Consistent detection of 2019 novel coronavirus in saliva. Clin Infect Dis 2020 Feb 12; ciaa149. doi: 10.1093/cid/ciaa149.
33) To KK, Tsang OT, Leung WS, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis 2020; 20: 565-574.
34) 国⽴感染症研究所. 2019-nCoV (新型コロナウイルス)感染を疑う患者の検体採取・輸送マニュアル〜2020/06/02 更新版〜
https://www.niid.go.jp/niid/images/pathol/pdf/2019-nCoV_200602.pdf
35) Irving SA, Vandermause MF, Shay DK, et al. Comparison of nasal and nasopharyngeal swabs for influenza detection in adults. Clin Med Res 2012; 10: 215-218.
36) Tu YP, Jennings R, Hart B, et al. Swabs collected by patients or health care workers for SARSCoV-2 testing. N Engl J Med 2020 Jun 3;NEJMc2016321. doi: 10.1056/ NEJMc2016321.
37) ⽇本感染症学会. 抗インフルエンザ薬の使⽤について 2019 年 10 ⽉ 24 ⽇
http://www.kansensho.or.jp/uploads/files/guidelines/191024_teigen.pdf
38) Takashita E, Daniels RS, Fujisaki S, et al. Global update on the susceptibilities of human influenza viruses to neuraminidase inhibitors and the cap-dependent endonuclease inhibitor baloxavir,
2017-2018. Antiviral Res 2020 Mar; 175:104718. doi: 10.1016/j.antiviral.2020.104718.
39) 国⽴感染症研究所 抗インフルエンザ薬耐性株サーベイランス 2020 年 6 ⽉ 30 ⽇, https://www.niid.go.jp/niid/ja/influ-resist.html
40) Hirotsu N, Sakaguchi H, Sato C, et al. Baloxavir marboxil in Japanese pediatric patients with influenza: safety and clinical and virologic outcomes. Clin Infect Dis 2019 Sep 20:ciz908. doi:1310.1093/cid/ciz908
41) Sato M, Takashita E, Katayose M, et al. Detection of variants with reduced baloxavir marboxilsusceptibility after treatment of children with influenza A during the 2018-2019 influenza season.J Infect Dis 2020; 222: 121-125.
42) Ikematsu H, Kawai N, Tani N, et al. Duration of fever and PA/I38X-substituted virus emergencein patients treated with baloxavir in the 2018-2019 influenza season. J Infect Chemother 2020; 26:400-402.
43) Yoshii N, Tochino Y, Fujioka M, et al. The comparison of the efficacy of baloxavir andneuraminidase inhibitors for patients with influenza A in clinical practice. Intern Med 2020; 59:1509-1513.
44) Ison MG, Portsmouth S, Yoshida Y, et al, Early treatment with baloxavir marboxil in high-riskadolescent and adult outpatients with uncomplicated influenza (CAPSTONE-2): a randomised,placebo-controlled, phase 3 trial. Lancet Infect Dis 2020 Jun 8:S1473-3099(20)30004-9. doi:10.1016/S1473-3099(20)30004-9.
45) Venkatesan S, Myles PR, Bolton KJ, et al. Neuraminidase inhibitors and hospital length of stay: ameta-analysis of individual participant data to determine treatment effectiveness among patientshospitalized with nonfatal 2009 pandemic influenza A (H1N1) virus infection. J Infect Dis 2020;221: 356-366.
46) Butler CC, van der Velden AW, Bongard E, et al. Oseltamivir plus usual care versus usual care forinfluenza-like illness in primary care: an open-label, pragmatic, randomised controlled trial.Lancet 2020; 395: 42-52.
47) Roosenhoff R, Reed V, Kenwright A, et al. Viral kinetics and resistance development in childrentreated with neuraminidase inhibitors: the Influenza Resistance Information Study (IRIS). ClinInfect Dis 2019 Sep 27:ciz939. doi: 10.1093/cid/ciz939.
48) Fujita M, Matsumoto H, Inafuku Y, et al. A retrospective observational study of the treatment of anosocomial infection caused by oseltamivir-resistant influenza virus A with baloxavir marboxil.Respir Investig 2020 Jun 27:S2212-5345(20)30068-X. doi: 10.1016/j.resinv.2020.05.002.
49) Du Z, Nugent C, Galvani AP, et al. Modeling mitigation of influenza epidemics by baloxavir. NatCommun 2020 Jun 2;11(1):2750. doi: 10.1038/s41467-020-16585-y.
50) 藤⽥医科⼤学. ファビピラビル(アビガン)特定臨床研究の最終報告について. 2020 年 7 ⽉ 10 ⽇https://www.fujita-hu.ac.jp/news/j93sdv0000006eya.html
⼩児(特に乳幼児〜⼩学校低学年) 2020-2021
Ⅵ 基本的な考え
1.⼩児の SARS-CoV-2 感染症(COVID-19)の特徴
1)⽇本では⼩児の患者報告は少ないのですが、⽶国⼩児科学会によると、7 ⽉ 16 ⽇の時点で、24 万⼈以上の⼩児 COVID-19 症例の報告があり、成⼈を含めた全症例の約 8%を占め、全⼊院例の 0.8%から 2.9%が⼩児(州別)とされています。⼩児の COVID-19 症例では、0.6%から 9.1%(州別)が⼊院となっています。⼩児の致命率は 0〜0.2%(州別)、⼩児の死亡は成⼈も含めた全死亡例の 0〜0.5%(州別)ですが、全⽶で 63 例の⼩児が死亡しています 1)、2)(*⽶国の⼩児の年齢区分は州によって異なり、0-14 歳、0-17 歳、0-18 歳、0-19 歳、0-24 歳の範囲で年齢が区分されています)。
2)SARS-CoV-2 に感染しても無症状や軽症の患者が多く 3.)、4)、発熱や呼吸器症状がないことがあります。外来の⼀般的な診察のみで感染者と⾮感染者とを区別することは困難です。
3)過去の報告で、SARS-CoV-2 と他の呼吸器病原体との重感染が、少なからず認められます5)。すなわち、SARS-CoV-2 陽性であっても、他の病原体との重感染が否定できないことや、他の病原体が陽性であっても SARS-CoV-2 との重感染が否定できないことにも注意しなければなりません。⼩児ではインフルエンザ A 型と⽐較すると、COVID-19 の臨床症状は軽度であること、⾎液検査では⽩⾎球数、好中球数および CRP は低値であること、胸部 CT ではスリガラス陰影を認める症例が多いことも報告されています 6)。
4)神経系疾患、遺伝性疾患、先天性⼼疾患などを持つ等の⼩児は重症化しやすいので、経過を慎重に観察することが必要です 7)。またどの年齢においても、悪性腫瘍、慢性腎疾患、慢性閉塞性肺疾患、臓器移植後の免疫不全者、肥満、重度の⼼疾患、鎌状⾚⾎球症、2 型糖尿病は重症化リスクがあるとされています。5)で述べる川崎病類似の症候群については重症化例が多いものの、その危険因⼦は不明です。
5)⽇本では 2020 年 7 ⽉時点では報告がないものの、PIMS-TS(Pediatric InflammatoryMultisystem Syndrome Temporally Associated With SARS-CoV-2)と呼ばれる 10 歳前後に多く⾒られる川崎病類似の症候群も海外では注⽬されています 8)。SARS-CoV-2 感染から、中央値で、25 ⽇後に発症するのが特徴です。発熱や消化器症状、CRP ⾼値の他、半数に発疹、結膜充⾎、ショック、⼀部の症例に冠動脈拡張または動脈瘤が認められます 8)。ほとんどが重症例であり、80%の患者が ICU に⼊院し、20%が⼈⼯換気療法を受け、2%が死亡したと報告されています。中国からの報告はありませんが、英国、フランス等、ヨーロッパからも多数報告されている、⼩児の⽣命を脅かす疾患です 9)。
2.今冬は、COVID-19 とインフルエンザの同時流⾏も懸念されるので、⼩児へのインフルエンザワクチンについても、接種が強く推奨されます。Social Distancing Strategy が維持できれば、今冬のインフルエンザ流⾏は⼩さくなる可能性もあります。2020 年 7 ⽉現在冬の南半球でインフルエンザの明らかな流⾏もないようです1510) 。ただし、現状のインフルエンザサーベイランスシステムは、COVID-19 の流⾏による受診⾏動が変化したため、必ずしも実態を反映していない可能性があり、我が国においても考慮しておかねばならないと考えます。
3.年少児は、啼泣する、マスクができない、吸⼊や吸引を必要とする基礎疾患を有する児が多い、処置や診察に介助が必要、あやしたり傍にいてあげる必要がある、などの特徴があり、⼈⼿を要し密になったり、エアロゾルを発⽣させやすい環境にあります。
4.⼩児例は同居家族や園・学校を発端者とした濃厚接触者スクリーニングで発⾒される場合が多く、⼩児を発端者としてのクラスター発⽣の報告はほとんどありません。そのため、⼩児科の診察にあたっては、周囲の流⾏状況を確認することが⼤切です。また、⼩児と成⼈とを⽐較した場合、⼩児でのウイルス RNA 量やウイルス排泄期間は成⼈と同様であるとの報告ありますが 11)、⼀般的に⼩児の間での流⾏はほとんどみられておりません 12)、13)。インフルエンザは、⼩中学校が流⾏増幅の場となるので、学級閉鎖、休校が、インフルエンザ対策として有効と考えられています。⼀⽅で、COVID-19 の学校内感染は、当初考えられていたほど重要でないという報告もあり、Social Distancing Strategy 下での学校閉鎖では効果が限定的である可能性が⽰唆されます 14)。数理モデルを⽤いた解析では、無症候感染者の 50%が周囲に感染させると仮定すると、学校閉鎖によりピーク時の感染者数を 10〜20%程度減少させると予想されます 15)。
5.インフルエンザ迅速診断キットの出荷量は年間 2000〜3000 万キットですが、SARS-CoV-2 迅速抗原検査キットの供給量は少なく、今冬初めは各クリニックおよび病院で確保できるキット数は限られることが予想されます。そのため、インフルエンザ迅速診断キットと同様の頻度で使⽤することが困難である場合は、同じ都道府県であっても、医療圏内の流⾏状況・濃厚接触の有無・14 ⽇以内の流⾏地域への移動歴を考慮して、使⽤適応を判断する必要があります。
6.感染症診療の基本である「診断→治療」の流れは守ることが⼤切です。⼩児では、インフルエンザ/COVID-19 以外に、RS ウイルス、ヒトメタニューモウイルス、アデノウイルス、溶連菌、マイコプラズマなど、迅速抗原あるいは核酸増幅検査(PCR 法や LAMP 法など)で診断可能な感染症や、その他突発性発疹や尿路感染症など、発熱を呈する感染症が多く存在します。また、⾮感染性の発熱(川崎病含む)もまれではありません。インフルエンザやCOVID-19 などの感染症は、明確な出席停⽌や隔離解除基準があるため、根拠のある診断をしないと、登園・登校に⽀障が出ます。本提⾔では、インフルエンザと SARS-CoV-2 について説明します。
7.実施すべき診療は必ずしも抗原検査と核酸増幅検査だけではありません。例えば、呼吸困難を認めれば聴診・酸素飽和度測定・胸部単純 X 線検査(誤嚥なども鑑別)なども有⽤です。
Ⅶ 診断・検査-総論
(1)発熱や呼吸器症状を認めるほか、接触歴があるなど、COVID-19 を除外できない場合には、医療者の接触頻度をできる限り減らすことと PPE の節約の⾯からも、病原体検出のための検体はなるべく同時に採取します(例:SARS-CoV-2 とインフルエンザウイルスと RS ウイルス、など)。地域の流⾏状況に応じて、先にインフルエンザの検査を⾏って抗インフルエンザ薬を投与し、2 ⽇程度経過しても患児の経過が思わしくなかった場合には、その時点で SARSCoV-2 迅速診断キット(キットの供給状況により核酸増幅検査)を⾏う場合もあります。発症2⽇⽬に両⽅⾏った場合には、どちらの疾患であっても陽性となりやすく、また抗インフルエンザ薬の治療開始(発症 48 時間以内)を満たします。SARS-CoV-2 迅速診断キット(キットの供給状況により核酸増幅検査)の陽性は、その治療には直接結びつきませんが、周囲への感染拡⼤防⽌や、その後の経過を推測することに役⽴ちます。
(2)インフルエンザの流⾏の主体は⼩児であり、迅速診断キットを⽤いず発熱等の症状から「インフルエンザ」と診断すると、次に挙げる問題点が⽣じる可能性がありますので、できる限り迅速診断キットを⽤いた確定診断が⼤切です。但し、流⾏期の陰性的中率は低いので、診断はあくまで総合診断です。
①⼩児では発熱性疾患が多く、その他の重症疾患を⾒逃す可能性があります。
②「インフルエンザ」と診断されると、登園・登校停⽌となる患者も増加するため、過去のインフルエンザシーズンと⽐較し、休園、学級もしくは学年閉鎖、さらには休校する施設が多くなり、保育園・幼稚園および学校活動への影響が⼤きくなります。
③⾒かけ上、インフルエンザ(いわゆるインフルエンザ様疾患)の患者が爆発的に増えるため、真のインフルエンザ流⾏状況を把握することが難しくなります。さらに、インフルエンザウイルスと SARS-CoV-2 との疫学的な関連性について検討することも難しくなることが考えられます。このため、各地域でのインフルエンザ定点サーベイランスの運⽤とデータの解釈には注意する必要があります。
④全例に抗インフルエンザ薬治療を⾏った場合、抗ウイルス薬による薬剤低感受性ウイルスの選択圧が⾼まります。薬剤低感受性ウイルスが検出される頻度が⾼まるかは不明ですが、その可能性については否定できません。
⑤必ずしもインフルエンザ迅速診断キットを⽤いて検査診断しなくてよい場合は、以下のような状況があげられます。
・家族内感染が疑われる状況、疫学的視点から強くインフルエンザが疑われる状況☞ 検査しないで治療:Ⅸ.治療の実際(2)⑧ 参照
Ⅷ 検査診断の実際
(1)当該医療機関の医療圏、隣接する医療圏、都道府県全体での COVID-19 流⾏状況により、レベルを設定します(表 5)。
(2)各レベルにおいて、受診患者(有症状者)がいずれに該当するか検討し、SARS-CoV-2 の(抗原)検査(キットの供給状況により核酸増幅検査)を⾏うかどうかを判断します(表 6)。
(3)医療者への曝露リスク、流⾏時における業務の効率化からみた、検体採取部位、検体採取場所、PPE の⽬安を規定します(表 7)。適切な検体の種類と検査⽅法の組み合わせについては、説明書や保険適⽤などを参考にします。⼊院・⼊所施設においては、1例⽬を積極的にみつけることや、⼊院してから陽性が判明して院内感染が拡⼤しないようにすることが⼤切であるため、SARS-CoV-2 迅速診断キット(キットの供給状況により核酸増幅検査)を検査実施基準の閾値を下げて使⽤することが想定されます。⼀⽅、外来や診療所においては、その意義は少ないかもしれませんが、地域の流⾏状況によっては閾値を下げることが必要な場合もあります。
(4)SARS-CoV-2 迅速抗原検査に関わる留意事項①「新型コロナウイルス感染症を疑う症状発症後 2 ⽇⽬以降から9⽇⽬以内の者(発症⽇を1 ⽇⽬とする)については、本キットで陰性となった場合は追加の核酸増幅検査を必須とはしない。⼀⽅で、核酸増幅検査(PCR)と⽐較して検出に⼀定以上のウイルス量が必要であることから、現時点では、無症状者に対する使⽤、無症状者に対するスクリーニング検査⽬的の使⽤は、適切な検出性能を発揮できず、適さない。」とされています 16)。②保健所との検体検査の契約の⽅法、検査実施件数や結果の届出、感染防護体制、保険適⽤については、各⾃治体等に確認してください。
(5)参考)SARS-CoV-2 迅速診断キット 2020 年 7 ⽉時点
①ルミパルス® ⿐咽頭ぬぐい液⼜は唾液
https://www.pmda.go.jp/files/000235412.pdf
②エスプライン® ⿐咽頭ぬぐい液https://www.info.pmda.go.jp/tgo/pack/30200EZX00026000_A_01_04/30200EZX00026000_A_01_04?view=body
<筆者追記>上記URLは存在しない。おそらく以下が正しい。
https://www.info.pmda.go.jp/downfiles/ivd/PDF/670773_30200EZX00026000_A_01_06.pdf
| Level | 当該医療機関がカバーする医療圏 | 隣接する医療圏 | 都道府県全体 |
|---|---|---|---|
| 1 | 14 ⽇以内のCOVID-19 発⽣例なし | 14 ⽇以内の COVID-19 発⽣例なし。 | 14 ⽇以内の COVID-19 発⽣例なし。 |
| 2 | 14 ⽇以内のCOVID-19 発⽣例なし | 14 ⽇以内に感染経路が特定できている COVID-19 発⽣例がある(クラスター事例含む)。 | ・14 ⽇ 以 内 に 感 染 経 路 が 特 定 で き て い る COVID-19 発⽣例がある。 ・14 ⽇以内に限られた地域にのみ、感染経路が不明なクラスターが発⽣している。 |
| 3 | 14 ⽇以内に感染経路が特定できているCOVID-19 発⽣例がある。 | 14 ⽇以内に感染経路が不明のCOVID-19 発⽣例がある(クラスター事例含む)。 | 14 ⽇以内に(地理的に交流の程度が低い)複数の地域で、それぞれ感染経路不明のクラスターが発⽣している。 |
| 4 | 14 ⽇以内に感染経路が不明の COVID-19発⽣例がある(クラスター事例含む)。 | 14 ⽇以内に感染経路が不明の COVID-19 クラスターが複数発⽣している。 | 14 ⽇以内に、すべての地域において、感染経路不明のクラスターが発⽣している。 |
・表 5、表 6 については、レベル分類と対応についての実例として挙げた。実際には、都道府県でのリスクアセスメントも参考にすること。
・医療圏:各地域で定義する。各医療圏内でさらに医療圏を細分化するかどうかは各医療機関の判断に委ねる。
・「当該医療機関がカバーする医療圏」、「隣接する医療圏」、「都道府県内全体」のいずれかの COVID-19 流⾏状況が当てはまるとき、当該レベルにあると
判断する。
・表 5、表 6 での区分については、厚労省の届出を参考にした 24)。
| Level | SARS-CoV-2 迅速診断キット(供給状況により核酸増幅検査)の適応 |
|---|---|
| 1 | ・原則不要。 ・14 ⽇以内に、陽性例の報告のあった都道府県への移動歴(居住歴も含む)がある、または移動歴(居住歴も含む)のある者と濃厚接触がある場合には考慮する。 |
| 2 | ・14 ⽇以内に、陽性例の報告のあった都道府県への移動歴(居住歴も含む)がある、または移動歴(居住歴も含む)のある者と濃厚接触がある場合には考慮する。 ・14 ⽇以内に COVID-19 のクラスター発⽣があった都道府県内地域への移動歴(居住歴も含む)がある、または移動歴(居住歴も含む)のある者と濃厚接触がある場合には考慮する。 |
| 3 | ・14 ⽇以内に、陽性例の報告のあった都道府県への移動歴(居住歴も含む)がある、または移動歴(居住歴も含む)のある者と濃厚接触がある場合には考慮する。 ・14 ⽇以内に COVID-19 のクラスター発⽣があった都道府県内地域への移動歴(居住歴も含む)がある、または移動歴(居住歴も含む)のある者と濃厚接触がある場合には考慮する。 ・14 ⽇以内に濃厚接触者の定義に当てはまる場合には⾏う。 |
| 4 | ・発熱がある場合には全例⾏うことが望ましい。 |
・核酸増幅検査とは、PCR 法や LAMP 法などを指す。
・表 5、表 6 については、レベル分類と対応についての実例として挙げた。実際には、都道府県でのリスクアセスメントも参考にすること。
・Level については、表 5 を参照。各レベルにおいて、受診患者(有症状者)が上記に該当する場合に、SARS-CoV-2 の検査を検討する。
・原因不明の肺炎、嗅覚味覚異常、年⻑者の川崎病様症状(PIMS-TS 想定)、濃厚接触者は、いずれのレベルでも適応となる可能性が⾼い。
PIMS-TS:Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2)と呼ばれる 10 歳前後に多く⾒られる川崎病類似の症候群
・表 5、表 6 での区分については、厚労省の届出を参考にした 24)。(疑うべく症例定義は、発熱、あるいは上気道症状、これに ILI、CLI を含む)
Ⅸ.治療の実際
⽇本感染症学会提⾔「〜抗インフルエンザ薬の使⽤について〜」17)
2019 年 10 ⽉の⽇本感染症学会提⾔「〜抗インフルエンザ薬の使⽤について〜」17)の内容については、バロキサビル低感受性株についての深い知⾒が得られなかったため、⼤きな修正は加えないものの、以下について追加します。
①2019-20 シーズンには、特に⼩児でバロキサビル使⽤中に薬剤低感受性株が検出されやすい A/H3N218)、19)がほとんど流⾏しませんでした。よって、A/H3N2 において、低感受性ウイルスが広く蔓延するかどうか、解決していません。
②バロキサビルは、A/H1N1 に処⽅しても 15%前後で低感受性ウイルスが選択されます 18)、19)。これは、オセルタミビルを投与した場合に、投与後に低感受性ウイルスが検出される割合(3〜4%)20)より⾼いと考えられます。
③⼀⽅、2019-2020 の国内分離株については、薬剤治療前の低感受性ウイルスは、A/H1N1 で 1/790、A/H3N2 で 0/63(⼩児〜成⼈)と、低い発⽣⽔準で推移しています(2020 年 7 ⽉ 21 ⽇現在)21)。
④バロキサビル投与後に低感受性ウイルスが選択された場合、解熱していても呼吸器などの有症状期間が⻑引くことが知られています 18)、19)。
⑤1 歳以上 12 歳未満のインフルエンザ患者 173 例を対象とした、多施設共同ランダム化⼆重盲検グローバル臨床試験の結果が報告されました 22)。バロキサビル単回投与群(115 例)は、対照群のオセルタミビル 5 ⽇間投与群(58 例)と⽐較して、安全性と有効性は同等でした 22)。
⑥国内で体重 20kg 未満の⼩児 33 例に対してバロキサビル 2%顆粒製剤を投与した成績23)も報告されました。2020 年 7 ⽉時点で本製剤は承認されていますが、未発売です。
⑦ラニナミビルのネブライザー吸⼊液は、エアロゾル発⽣のリスクがあるため、個室、換気の良い病室など、特定の条件下での使⽤を推奨します。
⑧医療従事者の安全性を求めるために、適切な診断を⾏わないまま、インフルエンザではないのに抗インフルエンザ薬が多く処⽅されることが懸念されます。本提⾔では、Ⅶ.(2)⑤にあるような疫学的⾒地からインフルエンザが強く疑われる状況を除いては、インフルエンザの迅速抗原検査診断を⾏い、同時あるいは経過により SARSCoV-2 迅速診断キット(供給により核酸増幅検査)を⽤いて SARS-CoV-2 の検査診断を⾏うことを推奨します。
文献
1) American Academy of Pediatrics. Children and COVID-19: State-Level Data Report. https://services.aap.org/en/pages/2019-novel-coronavirus-covid-19-infections/children-and-covid-19-state-level-data-report/
2020 年 7 ⽉ 22 ⽇アクセス.
2) American Academy of Pediatrics and the Childrenʼs Hospital Association. Children and COVID19: State Data Report. Summary of publicly reported data from 49 states, NYC, DC, PR, and GU.Version: 7/16/20. https://downloads.aap.org/AAP/PDF/AAP%20and%20CHA%20-%20Children%20and%20COVID-19%20State%20Data%20Report%207.16.20%20FINAL.pdf
2020 年 7 ⽉ 22 ⽇アクセス.
3) de Souza TH, Nadal JA, Nogueira RJN, et al. Clinical manifestations of children with COVID-19:A systematic review. Pediatr Pulmonol. 2020 Jun 3:10.1002/ppul.24885. doi: 10.1002/ppul.24885.Online ahead of print. https://pubmed.ncbi.nlm.nih.gov/32492251/
4) Dong Y, Mo X, Hu Y, et al. Epidemiology of COVID-19 Among Children in China. Pediatrics.2020 Jun;145(6):e20200702. doi: 10.1542/peds.2020-0702. Epub 2020 Mar 16.
https://pubmed.ncbi.nlm.nih.gov/32179660/
5) Zhu X, Ge Y, Wu T, et al. Co-infection with respiratory pathogens among COVID-2019 cases.Virus Res. 2020 Aug;285:198005. doi: 10.1016/j.virusres.2020.198005. Epub 2020 May 11. https://pubmed.ncbi.nlm.nih.gov/32408156/
6) Li Y, Wang H, Wang F, et al. Comparison of Hospitalized Patients with pneumonia caused byCOVID-19 and influenza A in children under 5 years. Int J Infect Dis. 2020 Jun 11;S1201-9712(20)30462-8. doi: 10.1016/j.ijid.2020.06.026. Online ahead of print. https://pubmed.ncbi.nlm.nih.gov/32535301/
7) Centers for Disease Control and Prevention. Coronavirus Disease 2019 (COVID-19) – Peoplewith Certain Medical Conditions. https://www.cdc.gov/coronavirus/2019-ncov/need-extraprecautions/people-with-medical-conditions.html
2020 年 7 ⽉ 25 ⽇アクセス.
8) Whittaker E, Bamford A, Kenny J, et al. Clinical Characteristics of 58 Children With a PediatricInflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. JAMA. 2020 Jun8:e2010369. doi: 10.1001/jama.2020.10369. Online ahead of print.
https://pubmed.ncbi.nlm.nih.gov/32511692/
9) Feldstein LR, Rose EB, Horwitz SM, et al. Multisystem Inflammatory Syndrome in U.S. Childrenand Adolescents. N Engl J Med . 2020.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7346765/
10)World Health Organization. Influenza update ‒ 372
https://www.who.int/influenza/surveillance_monitoring/updates/latest_update_GIP_surveillance/en/
2020 年 7 ⽉ 22 ⽇アクセス.
<筆者追記>上記URLはInfluenza updateの最新版が表示される。以下がInfluenza update ‒ 372のURLである。
https://www.who.int/influenza/surveillance_monitoring/updates/2020_07_20_update_GIP_surveillance/en/
11)Walsh KA, Jordan K, Clyne B, et al. SARS-CoV-2 detection, viral load and infectivity over thecourse of an infection. J Infect. 2020 Jun 29 doi: 10.1016/j.jinf.2020.06.067 [Epub ahead of print]
https://pubmed.ncbi.nlm.nih.gov/32615199/
12)Susanna Esposito, Nicola Principi. School Closure During the Coronavirus Disease 2019(COVID-19) Pandemic: An Effective Intervention at the Global Level? School Closure During theCoronavirus Disease 2019 (COVID-19) Pandemic: An Effective Intervention at the Global Level?JAMA Pediatr. 2020 May 13. doi: 10.1001/jamapediatrics.2020.1892. Online ahead of print.
https://pubmed.ncbi.nlm.nih.gov/32401277/
13)Munro APS, Faust SN. Children are not COVID-19 super spreaders: time to go back to school.Arch Dis Child. 2020 Jul;105(7):618-619. doi: 10.1136/archdischild-2020-319474. Epub 2020May 5.
https://pubmed.ncbi.nlm.nih.gov/32371442/
14)Lee B, Raszka WV, Jr. COVID-19 Transmission and Children. The Child Is Not to Blame.Pediatrics. 2020.
https://pubmed.ncbi.nlm.nih.gov/32457212/
15)Davies NG, Klepac P, Liu Y, et al. Age-dependent effects in the transmission and control ofCOVID-19 epidemics. Nat Med. 2020 Jun 16.
https://pubmed.ncbi.nlm.nih.gov/32546824/
16)厚⽣労働省, SARS-CoV-2 抗原検出⽤キットの活⽤に関するガイドライン.
https://www.mhlw.go.jp/content/000640554.pdf
2020 年 7 ⽉ 24 ⽇アクセス.
17)⽇本感染症学会.「〜抗インフルエンザ薬の使⽤について〜」.http://www.kansensho.or.jp/modules/guidelines/index.php?content_id=37. 2020 年 7 ⽉ 12 ⽇アクセス.
18)Hirotsu N, Sakaguchi H, Sato C, et al. Baloxavir marboxil in Japanese pediatric patients withinfluenza: safety and clinical and virologic outcomes. Clin Infect Dis. 2019 Sep 20;ciz908. doi:10.1093/cid/ciz908. Online ahead of print.
https://pubmed.ncbi.nlm.nih.gov/31538644/
19)Sato M, Takashita E, Katayose M, et al. Detection of Variants With Reduced Baloxavir MarboxilSusceptibility After Treatment of Children With Influenza A During the 2018-2019 InfluenzaSeason. J Infect Dis. 2020 Jun 16;222(1):121-125. doi: 10.1093/infdis/jiaa061.
https://pubmed.ncbi.nlm.nih.gov/32034420/
20)Lina B, Boucher C, Osterhaus A, et al. Five years of monitoring for the emergence of oseltamivirresistance in patients with influenza A infections in the Influenza Resistance Information Study.Influenza Other Respir Viruses. 2018 Mar;12(2):267-278.
https://pubmed.ncbi.nlm.nih.gov/29265727/
21)国⽴感染症研究所.抗インフルエンザ薬耐性株サーベイランス.https://www.niid.go.jp/niid/ja/influ-resist.html
2020 年 7 ⽉ 22 ⽇アクセス.
22)Baker J, Block SL, Matharu B, et al. Baloxavir Marboxil Single-dose Treatment in Influenzainfected Children: A Randomized, Double-blind, Active Controlled Phase 3 Safety and EfficacyTrial (miniSTONE-2). Pediatr Infect Dis J. 2020 Aug;39(8):700-705.
https://pubmed.ncbi.nlm.nih.gov/32516282/
23)Yokoyama T, Sakaguchi H, Ishibashi T, et al. Baloxavir Marboxil 2% Granules in JapaneseChildren With Influenza: An Open-label Phase 3 Study. Pediatr Infect Dis J. 2020. doi:10.1097/INF.0000000000002748. Online ahead of print.
https://pubmed.ncbi.nlm.nih.gov/32433222/
24)厚⽣労働省.新型コロナウイルス感染症(病原体がベータコロナウイルス属のコロナウイルス(令和⼆年⼀⽉に中華⼈⺠共和国から世界保健機関に対して、⼈に伝染する能⼒を有することが新たに報告されたものに限る。)であるものに限る。)―感染症法に基づく医師及び獣医師の届出について https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-shitei-01.html
2020 年 7 ⽉ 22 ⽇アクセス.
25)厚⽣労働省.新型コロナウイルスに関する Q&A(医療機関・検査機関の⽅向け).https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/dengue_fever_qa_00004.html#Q11.
2020 年 7 ⽉ 22 ⽇アクセス.
2020 年 8 ⽉ 1 ⽇
⼀般社団法⼈⽇本感染症学会 インフルエンザ-COVID-19 アドホック委員会
今村顕史、⼤曲貴夫、⾓⽥ 徹、釜萢 敏、川名明彦、國島広之、佐藤晶論、新庄正宜、菅⾕憲夫、⾕⼝清州、⽥村⼤輔、中野貴司、藤⽥次郎、三鴨廣繁、⽯⽥ 直(委員⻑)
利益相反⾃⼰申告
・國島広之はアステラス製薬(株)、アリーアメディカル(株)、MSD(株)、塩野義製薬(株)、第⼀三共(株)、⼤正富⼭医薬品(株)、ミヤリサン製薬(株)より講演料を受けている。
・菅⾕憲夫はアステラス製薬(株)、塩野義製薬(株)、第⼀三共(株)より講演料を受けている。
・中野貴司はアステラス製薬(株)、第⼀三共(株)、サノフィ(株)、ジャパンワクチン(株)、⽥辺三菱製薬(株)、デンカ⽣研(株)より講演料を受けている。
・藤⽥次郎は杏林製薬(株)、塩野義製薬(株)、第⼀三共(株)、ファイザー(株)より講演料を受けている。杏林製薬(株)より研究費を受けている。⼤塚製薬(株)、⼩野薬品⼯業(株)、第⼀三共(株)、⼤⽇本住友製薬(株)、富⼭化学⼯業(株)より奨学寄付⾦を受けている。
・三鴨廣繁は旭化成ファーマ(株)、アステラス製薬(株)、MSD(株)、杏林製薬(株)、塩野義製薬(株)、第⼀三共(株)、⼤正富⼭医薬品(株)、⼤⽇本住友製薬(株)、富⼭化学⼯業(株)、⽇本ベクトン・ディッキンソン(株)、ファイザー(株)、富⼠フイルム富⼭化学⼯業(株)、ミヤリサン製薬(株) 、Meiji Seika ファルマ(株)より講演料を受けている。
MSD(株)、(株)⼤塚製薬⼯業、積⽔メディカル(株)、(株)ティ・アシスト、東ソー(株)、富⼭化学⼯業(株)、ニットーボーメディカル(株)、⽇本ベクトン・ディッキンソン(株)、バイエル薬品(株)、ファイザー(株)、(株)フコク、プレシジョン・システム・サイエンス(株)、ミヤリサン製薬(株)、Meiji Seika ファルマ(株)、ロシュ・ダイアグノスティック(株)より研究費を受けている。
旭化成ファーマ(株)、アステラス製薬(株)、MSD(株)、塩野義製薬(株)、第⼀三共(株)、⼤正富⼭医薬品(株)、⼤⽇本住友製薬(株)、富⼭化学⼯業(株)、ファイザー(株)、富⼠フイルム富⼭化学(株)、富⼠フイルムファーマ(株)、ミヤリサン製薬(株)、Meiji Seika ファルマ(株)より奨学寄附⾦を受けている。
・⽯⽥ 直、今村顕史、⼤曲貴夫、⾓⽥ 徹、釜萢 敏、川名明彦、佐藤晶論、新庄正宜、⾕⼝清州、⽥村⼤輔については申告すべきものなし。
本内容は、⼀般社団法⼈⽇本感染症学会提⾔「今冬のインフルエンザと COVID-19 に備えて」の抜粋です。











コメントを残す