本内容は、 国立感染症研究所が公開する新型コロナウイルス感染症 病原体検出マニュアル 2019-nCoV Ver.2.6(2020年2月17日更新)の内容です。2020年2月18日現在における最新版のマニュアルです。
高い頻度で更新されていますが、RT-PCR 法による検出である点は変わっていません。
以下は別添を除く検出マニュアル全文です。
マニュアルの更新履歴
・本マニュアルについて:HP での公開用に多少の文言の修正や追加はありますが、基本的な検査内容は、すでに地方衛生研究所にお配りした「2019-nCoV 検査マニュアル Ver.2.3」と同じになっております。
・Ver.2.3(令和 2 年 2 月 5 日)から、キット比較についての情報を追記いたしましたが、検査法の内容についての変更はありません。
・Ver.2.4(令和 2 年 2 月 13 日)から、Ver.2.5.にかけての変更点。
(1)市販キットの製品番号の修正。
(2)喀痰処理法の追記。検査方法についての変更はありません。
・Ver.2.5(令和 2 年 2 月 15 日)から、Ver.2.6.にかけての変更点。
(1)陽性基準の記載内容の修正と追加記載。
(2)問い合わせ先の記載の削除。
新型コロナウイルス(2019-nCoV)の遺伝子領域2か所、open reading flame 1a (ORF1a)および spike (S) を特異的に検出する 2-step RT-PCR 法、あるいは TaqMan プローブを用いたリアルタイム one-step RT-PCR 法による遺伝子検査により 2019-nCoV を同定する。
操作法
検体の採取と保存
「2019-nCoV(新型コロナウイルス)感染を疑う患者の検体採取・輸送マニュアル」(国立感 染症研究所 HP)を参照のこと。 喀痰検体の扱いについては、別添の「喀痰検体の前処理法」を参照のこと。
RNA の抽出
広く使用されている QIAamp Viral RNA Mini Kit を用いた方法を示すが、他のウイルス RNA 抽出キットを用いてもよい。
材料、機器、器具および試薬
1) 機器・器具 冷却遠心機、1.5ml エッペンドルフチューブ用高速冷却遠心機、1.5ml エッペンドルフチ ューブ用卓上遠心機、ボルテックスミキサー、チューブ
2) 試薬 QIAamp Viral RNA Mini Kit (QIAGEN、Cat.No.52904)、エタノール、Distilled water (Deionized, Sterile, autoclaved, DNase free, RNase free、和光純薬工業、Cat No. 318-90105 など (以下 DDW)、陽性コントロール RNA
操作上の注意
1) 検体の取り扱いは、バイオセイフティーレベル 2+でおこなう。安全キャビネット内で 取り扱い、操作中は手袋・マスク等の personal protective equipment (PPE)を着用する。 チューブの蓋を開ける時には遠心し、チューブオープナーなどを用い、エアロゾルの発生 を極力防止する。
2) 実験室内遺伝子コンタミネーション防止と RNase の混入防止に細心の注意を払う。コ ンタミネーション防止には、試薬調製場所と PCR 産物などサンプルを扱う場所を物理的 に分けることが望ましい。できない場合は、それぞれの操作を別々のキャビネット内で行 う。
QIAamp Viral RNA Mini キットによる RNA の抽出
1) 使用前に行う試薬の調製等
(1) サンプルを室温 (15~25°C)に戻す。
(2) Carrier RNA 溶液 1µg/µl の調製Carrier RNA (凍結乾燥品)310µg の入ったチューブに Buffer AVE を 310µl 添加し、1µg/µl の溶液を調製する。Carrier RNA 溶液は、-20°C 保存で、凍結融解 3 回までなので、適した量に分注して保存する。Buffer AVL が沈殿を生じていた場合は、80°C でインキュベートし、沈殿を溶解した後、調製に使用する。
(3) Buffer AVL/Carrier RNA 混和物の調製
1 サンプルあたり Buffer AVL 560µl、Carrier RNA 溶液 5.6µl になるように Buffer AVL/Carrier RNA 混和物を調製する(詳細はキット添付の Handbook Table1.を参照)。2~8°C で保存すると沈殿物が生じるので、使用直前に 80°C でインキュベートし溶解する。このインキュベートは、5 分以内とする。なお、Buffer AVLL/Carrier RNA 混和物は、あらかじめ 560µl ずつ分注し、-20°C に保存しておくと便利である。
(4) Buffer AW1、Buffer AW2 の調製
Buffer AW1 (Kit Cat.No.51104)に 96~100%エタノールを 25ml 加える。
Buffer AW2 (Kit Cat.No.51104)に 96~100%エタノールを 30ml 加える。
2) 操作手順
以下の操作はすべて室温で行う。
(1) 1.5ml チューブに Buffer AVL/Carrier RNA 560µl を入れる。
(2) 検体 140µl と Buffer を充分混合するため 15 秒間 vortex にかけ、室温 (15~25°C)に 10 分間置く。チューブの壁面等に付着している液体を落とすため卓上遠心機で数秒間遠心する (スピンダウン)。
(3) エタノール (96~100%)560µl をチューブに加え、15 秒間 vortex をかけた後、チューブをスピンダウンする。
(4) (3)の液 630µl を QIAamp スピンカラム(2ml コレクションチューブ中)に入れ、蓋を閉め、6,000×g (8,000 rpm)、1 分間遠心する。QIAamp スピンカラムを新しい 2ml のコレクションチューブに移し、残りの(3)の液 630µl を入れ、同様に遠心し、全ての液が無くなるまで行う (この操作は 2 回で終わる)。
(5) QIAamp スピンカラムを開け、Buffer AW1 を 500µl 入れる。蓋を閉め、6,000×g(8,000 rpm)、1 分間遠心する。QIAamp スピンカラムを新しい 2ml のコレクションチューブに移し、ろ液の入っているチューブは捨てる。
(6) QIAamp スピンカラムを開け、Buffer AW2 を 500µl 入れる。蓋を閉め、20,000×g(14,000 rpm)、3 分間遠心する。スピンカラムとろ液等が接触することが無いよう静かに取り出す。接触した時には(7)を行う。
(7) QIAamp スピンカラムを新しい 2ml のコレクションチューブに移し、ろ液の入っているチューブは捨てる。フルスピード (20,000×g )で 1 分間遠心する。
(8) QIAamp スピンカラムを新しい蓋つき 1.5ml のチューブに移し、ろ液の入っているチューブは捨てる。QIAamp スピンカラムの蓋を開け、室温に戻したBuffer AVE を60µl入れ、蓋を閉めて 1 分間置いた後、6,000×g (8,000 rpm)、1 分間遠心し、ろ液を回収する。なお、抽出 RNA を保存するときは-80°C が望ましい。
2-step RT-PCR 法による 2019-nCoVの定性的検出法
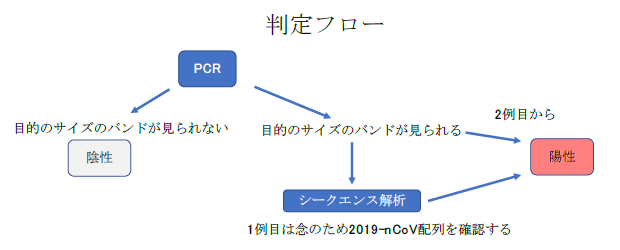
以下に検査・結果判定の概要図を示す。
例として SuperScript IV Reverse Transcriptase (Thermo)および Quick Taq HS Dymix (Toyobo)を用いた反応条件を示す。詳細はキットに添付のマニュアルを参照すること。尚、本マニュアルではプロトコルを1部変更している。なお逆転写反応、PCR 反応に用いる酵素等について、類似品で各施設において運用実績のあるものがあればそれを用いても良い。試薬等の分注操作は全て氷上にて行うことが望ましい。
必要な器具と試薬
1) 器具
サーマルサイクラー、マイクロピペット、チューブ、電気泳動層
2) 試薬
SuperScript IV Reverse Transcriptase (RT) [Thermo, Cat.No. 18090010. 50, 200 または 類似品(PrimeScript RT reagent Kit, Takara RR037A 等)]、[Quick Taq HS Dymix Toyobo DTM-101 または類似品(PerfectShot Ex Taq, Takara RR005A 等)]、2019-nCoV 特異的プ ライマー、Oligo(dT)12–18 Primer (Thermo, 18418012 または類似品)、Random Hexamers (Thermo, N8080127、または類似品。特に指定はない)、Recombinant RNase Inhibitor (Takara-Bio, 2313A、または類似品)、PCR クリーンアップキット(Wizard SV Gel and PCR Clean-Up System, Promega A9281、または類似品)、DDW

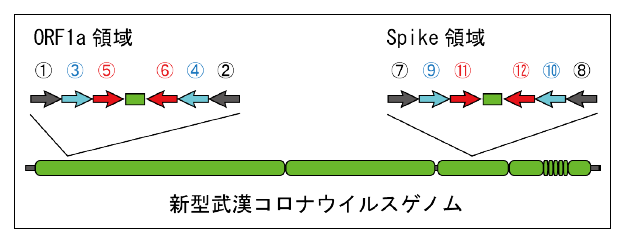
プライマー位置模式図
1st strand cDNA の合成
1) 陽性コントロールは ORF1a セット、S セットそれぞれ専用のものを用いる。105/µl に希釈された陽性コントロール RNA 10µl に DDW を 990µl 添加する。
2) 1)の陽性コントロール RNA 5µl に等量の DDW を加えて 10µl とし、以下に用いる (5000 コピーを用いる)。5000 コピーの検出が困難であるようならば、事前に検討を行い、 検出できる濃度で行ってよい。
3) 抽出された RNA 液および陽性コントロール RNA を用いて、表に示した反応液を調製 し、0.2ml チューブに入れる

4) サーマルサイクラーにて以下のプログラムで反応させる。
23℃ 10 min
50℃ 10 min
80℃ 10 min
5) 反応後、35µl の DDW を添加して希釈し、次の PCR 反応に用いる。
1st PCR 反応
1) 以下のように反応液を調整する。

ORF1a セットでは①NIID_WH-1_F501 および②NIID_WH-1_R913 S セットでは⑦WuhanCoV-spk1-f および⑧WuhanCoV-spk2-r を用いる。
2) 陰性対照として DDW 5µl を用いる。
3) 反応条件を以下のように設定し、PCR 反応を行う。

2nd PCR 反応
1) 以下のように反応液を調整する。

ORF1a セットでは③NIID_WH-1_F509 および④NIID_WH-1_R854 S セットでは⑨NIID_WH-1_F24381 および⑩NIID_WH-1_R24873 を用いる。
2) 陰性対照としてDDW 1µlを用いる。陰性対照の1stPCR産物を1µl用いても構わない。 どちらでも非特異増幅が起きないことは確認済みである。
3) 反応条件を以下のように設定し、PCR 反応を行う。

4) 反応終了後、1stPCR、2ndPCR 反応液ともに 5uL の増幅産物を用いて 2%アガロースゲ ル(アガロース ME, 岩井化学または同等品)で TAE バッファー(ニッポンジーンなど)電気泳動し、エチジウムブロマイド(または代用品)による染色後、バンドの有無について 確認を行う。1stPCR 終了後に 1st PCR のみの電気泳動を行っても構わない。泳動に際し、 必ずマーカーを置き、バンドサイズの確認ができるようにする。2~4%のアガロースゲ ルを用いることを推奨するが、他濃度でもバンドサイズの確認ができるようであれば用 いて構わない。 陽性コントロールの増幅サイズは以下のとおりである。
■ORF1a セット
1stPCR 292bp
2ndPCR 261bp
■ S セット
1stPCR 329bp
2ndPCR 294bp

5) 陽性コントロールで目的サイズのバンドが検出され、陰性コントロールで検出されないときに試験成立とする。2nd PCRで目的のサイズに近い大きさのバンドが検出された場合は陽性とする。されなければ陰性とする。
Nested RT-PCR においてはバンドが確認されれば陽性と考えることができるが、各施設における1例目の検出においては、シークエンス解析を行う事を推奨する。増幅産物から2019-nCoV 配列が確認されれば2例目からはシークエンス解析を行わなくてもよい。本Nested RT-PCRの検出感度は遺伝子配列解析に成功した検体中のコピー数から、3コピー前後と推定される。
(シークエンス解析を行う場合)PCR産物のクリーンアップ
PCR 産物のクリーンアップをしたのち、シークエンス解析を行う。例としてWizard SV Gel and PCR Clean-Up System を使用したものを示す。なお、他のクリーンナップ(Agencourt AMPure XP等)を使用してもよい。
1) 残りのPCR 産物(45μl)をPCR 産物と等量(45ul)のMembrane Binding Solutionと混合する。
2) SV minicolumnをCollection tubeに挿入し、1)をアプライし、室温で1分間培養し、16,000 ×gで1分遠心する。
3) Collection tube 中の廃液を捨て、SV minicolumn を戻し、エタノール添加済みのMembrane Wash Solutionを700μlアプライし、16,000 ×gで1分遠心する。
4) Collection tube 中の廃液を捨て、SV minicolumn を戻し、エタノール添加済みのMembrane Wash Solutionを500μlアプライし、16,000 ×gで5分遠心する。
5) Collection tube中の廃液を捨て、SV minicolumnを戻し、16,000 ×gで1分遠心する。
6) SV minicolumnを1.5mlチューブに挿入し、30μlのTEバッファー(あるいはDDW)をアプライし、室温で1分間培養し、16,000 ×gで1分遠心する。溶出液をシークエンス解析に用いる。
(シークエンス解析を行う場合)シークエンス解析
ORF1aセットでは⑤NIID_WH-1_Seq_F519および⑥NIID_WH-1_Seq_R840
Sセットでは⑪NIID_WH-1_Seq_F24383および⑫NIID_WH-1_Seq_R24865
を用いてサイクルシークエンス反応を行い、定法通りにシークエンス解析を行う。
配列が得られたらBlast 解析等を行い、MN908947 の配列と比較し、ほぼ一致(おおむね95%以上)するようであれば陽性とする。一致しない場合、ヒト染色体配列など明らかに2019-nCoVと異なる配列であった場合は陰性とする。シークエンス解析で波形が重なるなどして明瞭な配列が得られなかった場合、シークエンサーのメンテナンス状況を考慮したうえで、シークエンス解析をサイクルシークエンスから改めて行う。2 回目の解析でも明瞭な配列が得られない場合は、なんらかの非特異増幅である可能性が高いと考えられるため、陰性とする。
・ORF1aセット、Sセットのどちらか一方で2019-nCoV配列が確認できれば陽性と判断する。
TaqManプローブを用いたone-step RT-PCR法を用いる場合
機材および試薬
マイクロピペット(10、20、200、1000μl)、DDW、滅菌微量遠心チューブ(1.5ml)、96wellリアルタイムPCR反応プレート等、8連ストリップキャップまたはプレートシール、リアルタイムPCR装置、プライマー、TaqManプローブ、QuantiTect® Probe RT-PCR Kit (QIAGEN Cat#204443) [AgPath-ID One-step RT-PCR Reagents (Thermo Cat# AM1005)、TaqMan Fast Virus 1-Step Master Mix (Thermo Cat#4,444,432)のライトサイクラーでの動作は確認済み、ABI機器での動作報告有。他試薬でも検出感度の担保ができれば使用可能。
リアルタイム RT-PCR用プライマーおよびプローブについて


* Position はWuhan seafood market pneumonia virus isolate Wuhan-Hu-1MN908947.1由来である。
**:TAMRAでも動作確認済み。
***:Ver3 配列とミスマッチがあるが、ウイルスRNA の検出感度に影響がないことを確認済み。
リアルタイム one-step RT-PCR(TaqMan プローブ法)反応
例としてQIAGEN 社のQuantiTect® Probe RT-PCR kit を用いた反応条件を示した。詳細はキットに添付のマニュアルを参照すること。なお、試薬等の分注操作は全て氷上にて行う。
反応プレートの準備と解析
1) 陽性コントロールRNAはNセット用、N2セット用それぞれ専用のものを用いる。105/μlに希釈された陽性コントロールRNA 10μlをDDWに90μl添加し、十分混合したのちスピンダウンする。次に希釈した陽性コントロールRNA50μlをDDW450μlに添加し、十分混合したのちスピンダウンする(103/μl)。陽性コントロール用RNAは、実験室内コンタミネーションを起こした場合に、判別可能な外来塩基配列 (BamH IサイトおよびH5 陽性コントロールチェック用の配列)を挿入してあるので、所定のコントロールを必ず用いる。
2) 1)の陽性コントロールを5×103/5μl から5×100/5μl コピーまで10 倍階段希釈する。希釈方法は例えばDDW450μl にコントロールRNA50μl を添加し、十分混合したのち次の希釈へ移る。陽性コントロールの検出精度が確認されていれば1 点を用いでも構わない。
3) RNA抽出を行ったサンプルを用いて、表に示した反応液を調製する。

プライマー・プローブはあらかじめ混合してmix`を作製し、-30 度に保存して置いて構わない。
4) プレートあるいは8連チューブのウェルに15μlずつ反応液を入れる。陰性コントロールを5uLずつ2ウェルに添加する。
5) RNAを5μl ずつ2ウェルに加える。
6) 陽性コントロールRNA を5μl ずつ2 ウェルに加える。(段階希釈したものを用いる場合は濃度の薄いものからウェルに添加する)。陽性コントロールのコンタミネーション等を防ぐため、シーリングあるいはアルミ箔によるカバー等による工夫を勧める。
7) 反応条件を以下のように設定して反応を開始する。
<反応条件>
使用するリアルタイムPCR装置、試薬および反応容器等によって、最適な反応条件は異なるので、必ず事前に検出感度等の確認をしておく。以下に、試薬にQIAGEN 社 QuantiTect® Probe RT-PCR Kit、リアルタイムPCR 装置にApplied Biosystems 社 Applied Biosystems 7500 Fast リアルタイムPCRシステムもしくはRoche Diagnostics社 LightCycler 480 (または480II、96)を使用する場合の反応条件を示した。



8) 陽性コントロールの増幅曲線の立ち上りが40サイクル以内にみられ、かつ陰性コントロールの増幅曲線の立ち上がりが見られないときに試験が成立するとみなす。これまでの解析結果からは、NセットよりもN2セットの方が高い感度を示す傾向にある。検体において、N2 セット2 つのウェルのうち、一方あるいは両方で反応時間内に増幅曲線の立ちあがりが見られた場合に陽性とみなす。N2 セットが陰性で、N セットだけが陽性の場合で、陽性が1ウェルのみであり、しかもCt値(またはCq値)が高い場合には、非特異的な増幅の可能性が考えられるが、頻度は低いものの再解析の結果、N2 セットでの陽性が確認できた例もあるため、再試験を実施することを推奨する。N セット、N2 セットのいずれのウェルにおいても、反応時間内に増幅曲線の立ち上がりがない場合は陰性とする。
2nd derivative 法による自動判定などでは曲線が見られなくとも陽性と判断される場合がある。必ず増幅曲線、曲線の立ち上がりについてコントロールのものと比較して確認する。分離ウイルスから抽出したRNA(Accession LC521925)を使って本リアルタイムRT-PCR法の検出感度を測定したところ、N セットは7 コピー、N2 セットは2 コピーのウイルスRNAを検出できる計算である。
【キット間の比較について】
なお、ロシュ・ダイアグノスティックス株式会社のキット(LightMix® Modular SARS and Wuhan CoV 製品番号518-499921、518-499914)を用いて解析する場合、E gene ならびに N geneの両方を検査し、両方もしくは、いずれかの方で陽性とでれば、「SARS-like コロナウイルス陽性」と判定することを推奨する。感度に関しては、この判定基準を用いる限り、本マニュアルによる試験法と、同等と考えられる。
(参考)ロシュ・ダイアグノスティックス株式会社のインターナルコントロール及びMaster Mix:Modular EAV RNA Extract. Control(製品番号518-219963)、LigthCycler Multiplex RNA Virus Master
註1:SARS-like コロナウイルス (2003年流行のSARS-CoV ならびに、今回の新型コロナウイルス2019-nCoV )
註2:ロシュ・ダイアグノスティックス社のキットのE gene、N geneでは、2003年流行のSARS-CoVならびに、今回の新型コロナウイルス2019-nCoVを区別することはできませんが、現時点(以前のSARS-CoVの流行がない状況)での運用上、本試験陽性で、新型コロナウイルス2019-nCoV陽性と判定して問題ないと思われる。
執筆者一覧
白戸憲也 直亨則 松山州徳 竹田誠 (国立感染症研究所ウイルス第三部)
影山努(国立感染所研究所インフルエンザウイルス研究センター)
調恒明(山口県環境保健センター)
四宮博人(愛媛県立衛生環境研究所)










コメントを残す