更新日:2020年8月10日
現在、国内だけでも多くの新型コロナウイルス(SARS-CoV-2, COVID-19の原因ウイルス)の検査試薬キットが販売されています。その中において、公的医療保険適用かつ行政検査使用許可が出ている製品を紹介します。
保険適用かつ行政検査使用許可が出ている検査試薬キット
国立感染症研究所が公開している”臨床検体を用いた評価結果が取得された2019-nCoV 遺伝子検査方法について“の掲載順に並べています。また、当該資料では、国立感染症研究所が用意した臨床検体を用いた結果か、それとも独自にメーカーが用意した臨床検体を用いた結果かが区別されていますが、本記事ではその区別をしていません。
なお、詳細が不明な検査試薬キットについてはリンクを貼っていません。
(ア)通常の検査方法(逆転写及び遺伝子増幅に1時間以上かかるもの)
ロシュ・ダイアグノスティックス
LightMix Modular SARS-CoV(COVID19) E-geneおよびLightMix Modular SARS-CoV(COVID19) N-gene
LightMix® Modular SARS-CoV (COVID19)は、コバスz480(医療用機器)、LightCycler480(研究用機器)、LightCycler96(研究用機器)ならびに相当の能力を持ったリアルタイムPCR機器によってアッセイ可能なSARS-CoV-2検出用のプライマー・プローブのセット(研究用試薬)です。サルベコウイルス亜属に共通のE遺伝子、N遺伝子さらにSARS-CoV-2に特異的なRdRp遺伝子に加え、抽出コントロール試薬も用意しております。
BGI Genomics(シスメックス)
医学生物学研究所
国立感染症研究所「病原体検出マニュアル2019-nCoV」記載のリアルタイムone-step RT-PCR法による検出系を参考に、検出性能は維持しつつ、より効率的に検査が可能な試薬を完成させました。
その特徴は、新型コロナウイルス遺伝子の2ヵ所の領域を別々のチューブで反応して測定する国立感染症研究所の検出系を改良し、2ヵ所の領域を1つのチューブで反応して陽性か陰性かの判定が可能な点になります。これにより、操作性に優れた試薬となり、さらに、PCRの反応が正しく行われているかを確認できる内部標準を追加することで、検査の精度も向上しております。

(販売終了)
FLUOROSEARCH™ Novel Coronavirus (SARS-CoV-2) Detection Kit
ライフテクノロジーズジャパン
TaqMan SARS-CoV-2 Assay Kit v2(Multiplex)
中山大学達安基因株式有限会社
新型コロナウイルス 2019-nCoV 核酸検査キット(蛍光 PCR 法)
島津製作所
遺伝子増幅法(PCR法)により、新型コロナウイルス(SARS-CoV-2)を定性的に検出する試薬です。
鼻咽頭拭い液や唾液などの試料をRNAを精製することなく簡単な前処理だけで使用できます。

日本ベクトン・ディッキンソン
BD MAXTM ExKTM TNA-3 セット及び BD MAXTM PCR Cartridges の組み合わせ
BD マックス™ 全自動核酸抽出増幅検査システムは、核酸の抽出、増幅、検出工程のすべてを全自動で行う、ワークフローの効率性を最大限に高めた検査システムです。

東洋紡
新型コロナウイルス(SARS-CoV-2)検出のためのリアルタイム1-step RT-PCRキットです。試料を前処理液と混合後、RNA精製作業を行うことなく、リアルタイム1-step RT-PCR反応に供し、ウイルスRNAを検出します。
検出のためのプライマー、プローブは、国立感染症研究所発行の「病原体検出マニュアル2019-nCoV Ver.2.9.1」に記載されている、Nセット[Code:NCV-101]、N2セット[Code:NCV-102]を採用しています。

プロメガ(Promega)
GoTaq® Probe qPCR and RT-qPCR Systems
GoTaq® Probe qPCR および RT-qPCR System は ready-to-use の 2X マスターミックスで、プローブ法による qPCRの反応調製を簡便に行うことができます。これらのシステムは 様々な PCR 阻害物質の存在下でも 標的となるDNA あるいは RNAを高感度に検出できるようにデザインされています。
迅速なホットスタート活性化および増幅活性に優れた酵素により、GoTaq® Probe System は 標準またはファーストサイクリングを用いるほとんどのリアルタイム PCR 装置に適応します。室温でセットアップできる簡便性により、自動化あるいは多検体の検出フォーマットへ容易にスケールアップすることができます。

ホロジックジャパン株式会社
PCR法Polymerase Chain Reaction)と同じ核酸増幅法のひとつであるTMA法(Transcription Mediated Amplification)により新型コロナウイルスの検出を行う研究用試薬です。本試薬は
本試薬は国立感染症研究所が6月10日付で公開した「臨床検体を用いた評価結果が取得された2019-nCoV 遺伝子検査方法について」*に「感染研法との 一定の一致率を示した 遺伝子 検査方法」と記載され、6月8日付で新型コロナウイルス感染の有無を調べる検査法として保険の適用対象となりました。
また本試薬は弊社の全自動遺伝子検査システム「パンサーシステム」を用いることで、約3.5時間(核酸抽出行程含む)で新型コロナウイルスを検出することが可能です。パンサーシステムによりCOVID-19が疑われる患者検体を一日に1000検体測定可能になります。
Certest 社
VIASURE SARS-CoV-2 PCR (ORF1ab gene, N gene)
VIASURE SARS-CoV-2リアルタイムPCR検出キットは、臨床サンプル中のSARSCoV-2を識別および区別するために設計されています。
検出は、特定のターゲット配列の逆転写とその後の増幅が同じ反応ウェルで発生するワンステップリアルタイムRTフォーマットで行われます。
このリアルタイム検出キットには2つのバージョンがあります。

日本ベクトン・ディッキンソン
本試薬キットは新型コロナウイルス検出用の試薬として、米国では4月18日にアメリカ食品医薬品局(FDA)の緊急使用許可(EUA:Emergency Use Authorization)を取得し、既に販売されています。欧州では4月10日にCE-IVD(体外診断用医療機器指令)を取得しております。
新型コロナウイルス感染拡大防止の要となる、PCR検査(ポリメラーゼ連鎖反応)の検査数の増加と迅速化が求められています。本試薬キットは遺伝子の抽出から検出までを全自動で行うPCR検査装置「BD マックス™ 全自動核酸抽出増幅検査システム(以下、BD マックス)」専用の試薬キットです。本装置との組み合わせにより新型コロナウイルス遺伝子の抽出から、増幅、検出工程までを全自動で実施でき、検体を装置にセットしてから約2.5時間で24検体を同時に検査できます。本試薬キットは検査に必要な試薬類が予め分注されているプレフィルド方式であり、試薬の調製が不要で検体のコンタミネーション(汚染)のリスクやヒューマンエラーを防止するとともに、検査作業の効率化と標準化および検査精度の均一化を図ることが期待されます。
本試薬は、厚生労働省健康局結核感染症課及び国立感染症研究所による「臨床検体を用いた評価結果が取得された 2019-nCoV 遺伝子検査方法について」(2020年6月25日版)において、陽性一致率、及び陰性一致率ともに100%として結果が公表され、公的医療保険の適用対象となっております(厚生労働省保険局医療課発事務連絡令和2年6月25日、疑義解釈資料の総送付について(その18))。
アークレイ
i-densy Pack UNIVERSAL SARS-CoV-2キット
この度「i-densy Pack UNIVERSAL」を使用した新型コロナウイルス検出キットが「病原体検出マニュアル2019-nCoV」に準じた方法として認められました。アークレイが2009年より販売している遺伝子解析装置「i-densyシリーズ」は、全国の多くの医療機関に導入いただいており、院内における新型コロナウイルスの迅速なPCR検査を実現します。また、院内感染予防の観点で術前や新規患者への新型コロナウイルス検査を実施されている医療機関も増えており、今後ますます貢献が期待できます。「i-densy IS-5320」は、煩雑で手間のかかるPCR検査を全自動化し、迅速な結果報告のみならず、医療従事者の負担も軽減します。
ELITech社
エリート MGB SARS-CoV-2 キット
(イ)迅速な検査方法(逆転写及び遺伝子増幅が1時間未満のもの)
栄研化学
本製品は、生体試料中のSARS-CoV-2 RNAをRT-LAMP反応を用いて迅速簡便に検出する試薬です。あらかじめ反応チューブの蓋に乾燥した増幅試薬が固定されていますので、操作が簡単です。

杏林製薬
SARS-CoV-2 GeneSoC ER 杏林*
*装置のみ
ダナフォーム
理化学研究所(以下、理研)と神奈川県衛生研究所が開発した2019新型コロナウイルスの迅速検出方法に基づく研究用試薬です。 SmartAmp™(スマートアンプ)法とEprimer™を用い、一般的なリアルタイムPCR装置や等温増幅装置等を活用した等温核酸増幅により、検体より抽出したRNAから40分以内で迅速、かつ簡便に検出することが可能です。
キヤノンメディカルシステムズ
新型コロナウイルス RNA 検出試薬 Genelyzer KIT
遺伝子検出法である蛍光LAMP法を用い、国立大学法人 長崎大学とともに開発したものです。本試薬と専用装置 Genelyzer Fシリーズを用いた迅速遺伝子検出システム(以下、本システム)は3月に性能評価の結果が公表され、行政検査に使用することが可能となりました。本システムについて、これまで実用化研究を進めてきており、4月末の長崎クルーズ船乗組員集団感染例での行政検査などで実運用されています。迅速、高感度な遺伝子検出を実現するとともに、バッテリー駆動が可能なモバイル、コンパクトな特長を有しています。
世界的にも感染収束の先行きが見えない中、新型コロナウイルス遺伝子検査の間口を少しでも広げ、感染症対策に寄与することにより、社会の安心・安全に貢献していきます。
タカラバイオ
SARS-CoV-2 Direct Detection RT-qPCR Kit
富士フイルム 和光純薬
核酸(RNA)の抽出・精製から RNAをDNAに転換する逆転写反応、DNA の増幅・検出までの工程を全自動で行う装置です。マイクロ流路チップ内で遺伝子検出に必要な一連の工程を全自動で行うことができ、簡便な操作で迅速な測定を実現します。

SARS-CoV-2 RT-qPCR Detection Kit
新型コロナウイルス(SARS-CoV-2; COVID-19の原因ウイルス)をTaqMan®プローブを用いた1-step RT-qPCR法で検出する検査キットです。高い活性を持つHot Start Reverse Transcription DNA Polymeraseを用いた1酵素系RT-qPCR法を採用し、通常約130分かかるRT-qPCR反応を約45分間で終えられます。
キットには、国立感染症研究所の病原体検出マニュアル 2019-nCoV Ver.2.9.1に記載されているプライマーおよびプローブとポジティブコントロールRNAが含まれます。
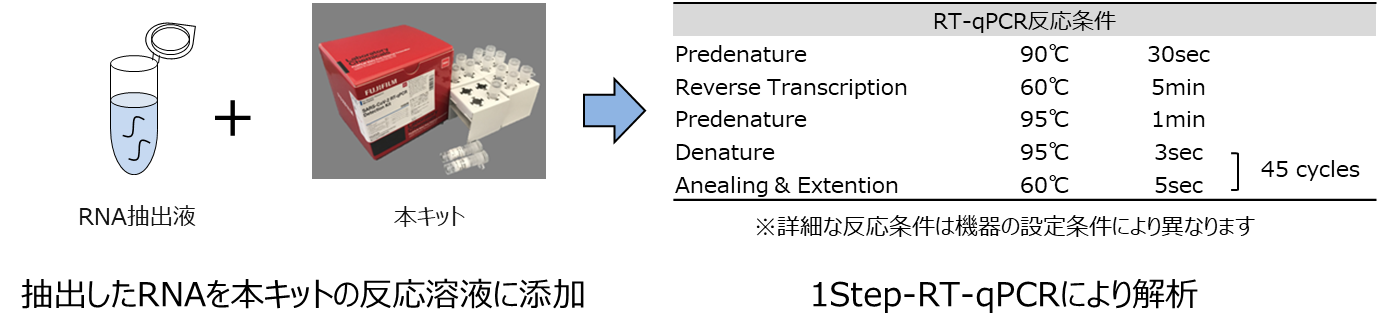
スディックスバイオテック
新型コロナウイルス検出キット SUDxSARS-CoV-2 detection kit
どのような検査試薬キットに行政検査使用許可が出るのか?
国立感染症研究所が公開している”臨床検体を用いた評価結果が取得された2019-nCoV 遺伝子検査方法について“に検査試薬キットが記載される必要があります。
記載されるためには以下の手順を経ます。
1. 臨床検体(陽性 10 検体、陰性 15 検体)を用い、国立感染症研究所法*との陽性一致率及び陰性一致率を求めた結果が陽性一致率及び陰性一致率ともに 90%以上を示す。
2. 本結果を厚生労働省に提出して承認を得る。
*国立感染症研究所の公開する病原体検出マニュアル 2019-nCoV Ver.2.9
これに記載された検査キットは、厚生労働省健康局結核感染症課の発行する”新型コロナウイルスに関する行政検査の遺伝子検査方法について(令和2年3月18日付)“において、行政検査に使用できるとされています。
公的医療保険の適用対象
国立感染症研究所の”臨床検体を用いた評価結果が取得された2019-nCoV 遺伝子検査方法について“に記載された製品は、厚生労働省保険局医療課の発行する”疑義解釈資料の送付について”において、記載製品を使用した検査は保険適用であることが明示されます。
性能不足の検査試薬キットがもたらした混乱
国立感染症研究所が市販の検査試薬キットの臨床データを公開する理由は何でしょうか。
通常、検査に使用されるキットは各国で診断薬としての承認を得たものです。もし性能が不十分と判断されれば薬事承認を得られません。この過程を経ることで、性能不足の検査試薬キットが医療現場で使われることを防止できます。
しかし、新型コロナウイルス(SARS-CoV-2)検査の需要が短時間で急速に高まったことにより、各国では特例措置として研究用試薬で検査をしてもかまわないとする方針を出しています。これは、研究用試薬は国の承認を得る必要がなく、各企業の判断で販売を開始できるため、診断薬よりも短期間で販売を開始できるからです。
ところが、その弊害で性能の不十分が研究用試薬の新型コロナウイルス(SARS-CoV-2)検出キットが複数現れました。
大規模な混乱を招いたものとして、イギリス政府が中国メーカーから購入した数百万個の検査試薬の返金を求めている事例が挙げられます。
デービッド・ブレナン(2020)中国製コロナ検査キット使い物にならず、イギリス政府が返金を要求へ. NewsWeek.
日本においては、国立感染症研究所が各検査キットの性能に基準を設けることで、体外診断薬としても薬事承認を経ていない検査試薬であっても一定の性能が保証されると言えます。
参考文献
国立感染症研究所(2020)臨床検体を用いた評価結果が取得された2019-nCoV 遺伝子検査方法について.
厚生労働省健康局結核感染症課(2020)新型コロナウイルスに関する行政検査の遺伝子検査方法について(令和2年3月18日付).
デービッド・ブレナン(2020)中国製コロナ検査キット使い物にならず、イギリス政府が返金を要求へ. NewsWeek.
こちらもチェック
更新履歴
<2020年8月10日>
販売中止:
FLUOROSEARCH™ Novel Coronavirus (SARS-CoV-2) Detection Kit
追加:
MEBRIGHT™ SARS-CoV-2 キット
GoTaq® Probe qPCR and RT-qPCR Systems
Aptima SARS-CoV-2
VIASURE SARS-CoV-2 PCR (ORF1ab gene, N gene)
BD マックス™ SARS-CoV-2
i-densy Pack UNIVERSAL SARS-CoV-2キット
エリート MGB SARS-CoV-2 キット
SUDxSARS-CoV-2 detection kit
変更:
東洋紡SARS-CoV-2 Detection Kit 仕様変更によりリンク先変更









コメントを残す